Jaka jest masa bezwzględna siarki? Zadania tematyczne - Egzamin z chemii: Zdam Egzamin Państwowy na „5”! Przykłady rozwiązywania problemów
Zjawiska chemiczne. Substancje
- Który z poniższych znaków charakteryzuje zjawiska chemiczne: a) zmiana koloru; b) zmiana stanu skupienia; c) zmiana kształtu; d) tworzenie się osadu?
- Czy zjawiska chemiczne zachodzą podczas: a) topnienia lodu; b) destylacja wody; c) rdzewienie żelaza; d) rozdzielenie mieszaniny przez filtrację; d) gnijące jedzenie?
- Które z poniższych substancji są proste, a które złożone: a) dwutlenek węgla; b) sól; c) miedź; d) wodór; e) aluminium; e) marmur? Jaka jest różnica między tymi grupami substancji?
- Kiedy nieznana złożona substancja spala się w tlenie, powstaje dwutlenek węgla i woda. Jakie pierwiastki chemiczne mogą występować w tej złożonej substancji? Które są wymagane? Wyjaśnij swoją odpowiedź.
Względne masy atomowe i molekularne. Stałość składu materii
- Średnia masa atomów siarki wynosi 5,31 ∙ 10 -26 kg. Oblicz względną masę atomową pierwiastka siarki, jeśli masa atomu węgla wynosi 1,993 ∙ 10 -26 kg.
- Oblicz względną masę cząsteczkową następujących substancji złożonych: a) chlorek magnezu MgCl2; b) kwas siarkowy H2SO4; c) wodorotlenek wapnia Ca(OH) 2; d) tlenek glinu Al 2 O 3; e) kwas borowy H 3 BO 3; e) siarczan miedzi (II) CuSO4.
- Magnez i siarka łączą się w stosunku masowym 3:4. Oblicz masę magnezu, która przereaguje z 20 g siarki.
- Zmieszano 21 g żelaza i 19 g siarki i mieszaninę ogrzano. Biorąc pod uwagę, że żelazo i siarka reagują w stosunku masowym 7:4, określ, która z substancji pozostanie nieprzereagowana. Oblicz masę substancji, która nie przereagowała.
Wzory chemiczne i obliczenia z ich wykorzystaniem
- Oblicz, w jakim stosunku masowym sód i tlen łączą się w związku Na 2 O.
- Skład chemiczny obejmuje wapń (ułamek masowy 29,4%), siarkę (23,5%) i tlen (47,1%). Ustal wzór tego związku.
- Oblicz stosunki masowe, w jakich wapń, węgiel i tlen występują w związku CaCO3.
- Ruda miedzi zawiera minerał chalkopiryt CuFeS 2 i inne zanieczyszczenia, których skład nie zawiera miedzi. Udział masowy chalkopirytu w rudzie wynosi 5%. Oblicz udział masowy miedzi w tej rudzie.
Wartościowość
- Określ wartościowość pierwiastków w następujących związkach: a) NH3; b) SO3; c) CO2; d) H2Se; e) P 2 O 3.
- Zapisz wzory związków tlenowych (tlenków) następujących pierwiastków: a) berylu (II); b) krzem (IV); c) potas (I); d) arsen (V).
- Napisz wzory związków manganu i tlenu, w których mangan jest dwu-, tri-, cztero- i siedmiowartościowy.
- Narysuj wzory chlorku miedzi (I) i chlorku miedzi (II), biorąc pod uwagę, że chlor w związkach z metalami jest jednowartościowy.
Równania chemiczne. Rodzaje reakcji
- Schemat reakcji CuCl 2 + KOH → Cu(OH) 2 + KCl odpowiada reakcji wymiany. Uporządkuj współczynniki na tym diagramie.
- Uzupełnij schematy reakcji i ułóż równania: a) Li + ... → Li 2 O; b) Al + O 2 → ...; c) Na + S → ... ; d) C + ... → CCl 4.
- Podaj po dwa przykłady każdego typu reakcji: rozkładu, łączenia i podstawienia. Zapisz równania tych reakcji.
- Zapisz równania reakcji aluminium z następującymi substancjami: a) chlorem; b) tlen; c) siarka (dwuwartościowa); d) jod (jednowartościowy).
Ilość substancji. Mol. Masa cząsteczkowa
- Oblicz ilość magnezu w próbce tego metalu o masie 6 g.
- Jaka jest masa mieszaniny składającej się z 10 moli gazowego wodoru i 5 moli tlenu?
- Oblicz ilość substancji zawartej w 100 g następujących substancji: a) fluorek litu LiF; b) tlenek krzemu (IV) SiO2; c) bromowodór HBr; d) kwas siarkowy H 2 SO 4.
- Oblicz masę próbki tlenku siarki(IV), która zawiera tyle cząsteczek, ile atomów znajduje się w kawałku żelaza o masie 1,4 g.
Obliczenia z wykorzystaniem równań chemicznych
- W wyniku oddziaływania wodoru i tlenu powstało 450 g wody. Jaka jest masa gazów, które przereagowały?
- Podczas kalcynacji wapienia (węglanu wapnia) CaCO3 powstaje tlenek wapnia i dwutlenek węgla. Jaką masę wapienia należy pobrać, aby otrzymać 7 kg tlenku wapnia?
- Po reakcji 13,44 g żelaza z chlorem powstał jeden z chlorków żelaza o masie 39 g. Określ wartościowość żelaza w powstałym chlorku i zapisz wzór związku.
- Aluminium o masie 10,8 g stopiono z szarą masą o masie 22,4 g. Oblicz ilość siarczku glinu Al 2 S 3 powstałego w wyniku reakcji.
Wymień główne postanowienia nauczania atomowo-molekularnego.
1. Substancje składają się z cząsteczek. Cząsteczka to najmniejsza cząsteczka substancji, która zachowuje swoje właściwości chemiczne. Cząsteczki różnych substancji mają różną masę, rozmiar, skład i właściwości chemiczne.
2. Cząsteczki składają się z atomów. Atom to najmniejsza cząsteczka substancji, pierwiastek chemiczny, który zachowuje swoje właściwości chemiczne. Pierwiastek chemiczny jest odrębnym rodzajem atomu. Właściwości chemiczne pierwiastka są określone przez strukturę jego atomów. Wszystkie pierwiastki chemiczne dzielą się na metale i niemetale.
3. Substancje, których cząsteczki składają się z atomów jednego pierwiastka, nazywane są prostymi (H 2 ; O 2). Substancje, których cząsteczki składają się z atomów różnych pierwiastków, nazywane są złożonymi (HCl). Zmiany alotropowe to zmiany, podczas których jeden pierwiastek tworzy różne proste substancje. Alotropia to powstawanie różnych prostych substancji przez jeden pierwiastek.
Powód alotropii:
a) różna liczba atomów (O 2 i O 3);
b) powstawanie kryształów o różnych modyfikacjach (diament i grafit);
4. Cząsteczki i atomy są w ciągłym ruchu. Szybkość ruchu zależy od stanu skupienia substancji. Reakcje chemiczne to chemiczna forma ruchu atomów i cząsteczek.
W wyniku reakcji chemicznych cząsteczki niektórych substancji przekształcają się w cząsteczki innych substancji. Ważną cechą substancji jest masa.
Pytanie nr 2
Jakie są podobieństwa i różnice w pojęciach „masy atomowej” i „masy względnej”?
1. Bezwzględna masa atomowa to masa grama wyrażona w gramach (g) lub kilogramach (kg)
m a () =1,67*10 -24 g
Używanie takich liczb jest niewygodne, dlatego stosuje się względne masy atomowe.
2. Względna masa atomowa pokazuje, ile razy masa danego atomu jest większa niż 1/12 masy atomu węgla.
1/12 masy atomu węgla nazywana jest jednostką masy atomowej (a.um.)
1 am = m a (C)/12 =(1,99*10 -23)/12 g = 1,66*10 -24 g
a r () = m a (H)/1 a.um = (1,67*10 -27 / 1,66*10 -24) = 1
Względna masa atomowa, w przeciwieństwie do masy absolutnej, nie ma jednostki miary.
Pytanie nr 3
Czy można połączyć pojęcia „kret” i „stała Avogadra”?
Mol to ilość substancji zawierająca 6,02 * 10 23 cząstek (cząsteczek lub atomów).
Wartość 6,02 * 10 23 mol-1 nazywana jest stałą Avogadra, którą oznaczamy Na
n = N/Na, gdzie
N - ilość substancji;
N to liczba atomów lub cząsteczek.
Pytanie nr 4
Porównaj liczbę atomów zawartych w chlorze i azocie, każdy o masie 10 g. W którym przypadku i ile razy liczba atomów jest większa?
|
Dany: m(Cl2)= 10g m(N2) = 10 g ___________ NCl2 –? N N –? |
Rozwiązanie M(Cl2) = 35,5 *2 = 71 g/mol N (Cl 2) = m(Cl 2)/ M(Cl 2) = 10 g/71 g/mol = = 0,14 mol N (Cl 2) = n (Cl 2) * Na = 0,14 mol |
|
6,02*10 -23 1/mol M(N2) =14*2 = 28 g/mol N (N 2) = m(N 2)/ M(Cl 2) = 10 g/28 g/mol = 0,36 mol N(N2) = n (N2) * Na = 0,36 mol * 6,02 * 10 23 1/mol = 2,17 * 10 23 N (Cl2) =(2,17*10 23) /0,843*10 23 =2,57 Odpowiedź: N (N2) > N (Cl2) 2,57 razy |
|
Pytanie nr 5
Średnia masa atomów siarki wynosi 5,31 * 10-26 kg. Oblicz względną masę atomową pierwiastka siarki. Masa atomu węgla – 12 wynosi 1,993 * 10 -26 kg.
|
Dany: m a (S)= 5,31*10 -26 kg m a (C) = 1,993*10 -26 kg ___________ ar(s) –? |
Rozwiązanie 1 amu = m a (C) /12 = (1,993*10 -26 kg) = 1,66*10-27 kg ar (s) = m a (S)/1 a.m.u. = 5,31*10-26 kg=32 Odpowiedź: ar(s) = 32. |
Pytanie nr 6
Próbka substancji o masie 6,6 g zawiera 9,03 * 10 22 cząsteczek. Określ masę cząsteczkową tej substancji.
Pytanie nr 7
Podaj pierwotne i współczesne sformułowanie prawa okresowości. Jaki jest powód ich różnicy?
Wstępne sformułowanie: charakterystyczne dla ciał prostych, a kształty i właściwości związków pierwiastków okresowo zależą od wielkości mas atomowych pierwiastków.
Nowoczesne sformułowanie: właściwości prostych substancji, a także formy i właściwości związków pierwiastków są okresowo zależne od wielkości ładunku jądra atomowego (liczby atomowej).
W układzie okresowym nie wszystkie pierwiastki są ułożone według rosnącej masy atomowej; są wyjątki, których nie potrafił wyjaśnić. Przewidział, że przyczyną jest złożoność struktury atomów. Odkrycie i badanie izotopów wykazało, że właściwości chemiczne wszystkich izotopów jednego pierwiastka są takie same, co oznacza, że właściwości chemiczne pierwiastka nie zależą od masy atomowej, ale od ładunku jądra.
Pytanie nr 8
Wyobraź sobie konfiguracje elektroniczne aluminium i skandu. Wyjaśnij, dlaczego umieszczono je w tej samej grupie „Układu Okresowego?” Dlaczego umieszcza się je w różnych podgrupach? Czy są to elektroniczne odpowiedniki?
aL i Se mają po trzy elektrony walencyjne, więc należą do tej samej grupy.
aL odnosi się do elementów p, a Se do elementów d, dlatego znajdują się one w różnych podgrupach i nie są analogami elektronicznymi.
Pytania nr 9
Spośród podanych poniżej konfiguracji elektronicznych wskaż te niemożliwe i wyjaśnij przyczynę niemożności ich realizacji
1р 3; 3p 6; 3S2; 2S2; 2d 5 ; 5d 2; 2p 4 ; 3p 7
Pytanie nr 10
Symbol izotopu pierwiastka. Podaj nazwę elementu; liczba neutronów i protonów; liczba elektronów w powłoce elektronowej atomu.
Ten pierwiastek o liczbie atomowej 92 i masie względnej 238 to uran.
Liczba protonów wynosi 92, a liczbę neutronów określa różnica między względną masą atomową a liczbą atomową, równą 238 – 92 = 146. Numer mi jest określany na podstawie numeru seryjnego elementu i wynosi 92.
Pytanie nr 11
Jądro atomu jakiegoś pierwiastka zawiera 16 neutronów, a powłoka elektronowa zawiera 15 elektronów. Podaj nazwę pierwiastka, którego izotopem jest ten atom. Podaj symbol tego pierwiastka chemicznego oraz wskaż ładunek jądrowy i liczbę masową.
Fosfor (P) jest pierwiastkiem zawierającym 15 elektronów.
Masę atomu określa się na podstawie sumy mas protonów i neutronów.
Ponieważ jądro atomu zawiera 16 neutronów i 15 protonów, jego liczba masowa wynosi 31. Można to zapisać w następującej formie:
KSIĄŻKI UŻYWANE
- Ilościowa charakterystyka substancji
- Rozwiązywanie problemów łączonych w oparciu o ilościowe cechy substancji
- Rozwiązywanie problemów. Prawo stałości składu substancji. Obliczenia z wykorzystaniem pojęć „masa molowa” i „ilość chemiczna” substancji
- Rozwiązywanie problemów obliczeniowych w oparciu o ilościowe charakterystyki materii i prawa stechiometryczne
- Rozwiązywanie problemów obliczeniowych w oparciu o prawa stanu skupienia gazu
Achmetow N.S. Chemia ogólna i nieorganiczna.
Pilipenko. Podręcznik chemii elementarnej.
Chomczenko I.G. chemia ogólna
1. Uzupełnij luki w zdaniach.
Bezwzględna masa atomowa pokazuje masę jednej dwunastu części 1/12 masy jednej cząsteczki izotopu węgla 12 6 C mierzoną w jednostkach: g, gk, mg, tj.
Względna masa atomowa pokazuje, ile razy masa danej substancji pierwiastka jest większa od masy atomu wodoru; nie ma jednostki miary.
2. Korzystając z zapisu, zapisz wartość zaokrągloną do liczby całkowitej:
a) względna masa atomowa tlenu - 16:
b) względna masa atomowa sodu - 23;
c) względna masa atomowa miedzi - 64.
3. Podano nazwy pierwiastków chemicznych: rtęć, fosfor, wodór, siarka, węgiel, tlen, potas, azot. W puste komórki wpisz symbole pierwiastków tak, aby otrzymać rząd, w którym wzrasta względna masa atomowa.
4. Podkreśl zdania prawdziwe.
a) Masa dziesięciu atomów tlenu jest równa masie dwóch atomów bromu;
b) Masa pięciu atomów węgla jest większa niż masa trzech atomów siarki;
c) Masa siedmiu atomów tlenu jest mniejsza niż masa pięciu atomów magnezu.
5. Wypełnij diagram.

6. Oblicz względne masy cząsteczkowe substancji na podstawie ich wzorów:
a) M r (N 2) = 2*14=28
b) M r (CH 4) = 12+4*1=16
c) M r (CaCO3) = 40+12+3*16=100
d) M r (NH 4Cl) = 12+41+35,5=53,5
e) M r (H 3PO 4) = 3*1+31+16*4=98
7. Przed tobą piramida, której „kamieniami konstrukcyjnymi” są wzory związków chemicznych. Znajdź taką drogę od wierzchołka piramidy do jej podstawy, aby suma względnych mas cząsteczkowych związków była minimalna. Wybierając każdy kolejny „kamień” trzeba liczyć się z tym, że wybrać można tylko ten, który bezpośrednio sąsiaduje z poprzednim.

W odpowiedzi zapisz wzory substancji znajdujących się na zwycięskiej ścieżce.
Odpowiedź: C 2 H 6 - H 2 CO 3 - SO 2 - Na 2 S
8. Kwas cytrynowy znajduje się nie tylko w cytrynach, ale także w niedojrzałych jabłkach, porzeczkach, wiśniach itp. Kwas cytrynowy stosuje się w kuchni i gospodarstwie domowym (na przykład do usuwania plam rdzy z tkanin). Cząsteczka tej substancji składa się z 6 atomów węgla, 8 atomów wodoru, 7 atomów tlenu.
C 6 H 8 O 7
Sprawdź prawidłowe stwierdzenie:
a) względna masa cząsteczkowa tej substancji wynosi 185;
b) względna masa cząsteczkowa tej substancji wynosi 29;
c) względna masa cząsteczkowa tej substancji wynosi 192.
DEFINICJA
Siarka- szesnasty element układu okresowego. Oznaczenie - S od łacińskiego „siarki”. Znajduje się w trzecim okresie, grupa VIA. Odnosi się do niemetali. Ładunek jądrowy wynosi 16.
Siarka występuje w przyrodzie zarówno w stanie wolnym (siarka rodzima), jak i w różnych związkach. Bardzo powszechne są związki siarki z różnymi metalami. Wiele z nich to cenne rudy (na przykład ołowiany połysk PbS, mieszanka cynku ZnS, miedź połyskująca Cu 2 S) i służą jako źródło metali nieżelaznych.
Wśród związków siarki powszechne w przyrodzie są także siarczany, głównie wapnia i magnezu, wreszcie związki siarki występują w organizmach roślin i zwierząt.
Masa atomowa i cząsteczkowa siarki
Względna masa cząsteczkowa substancji (Mr) jest liczbą pokazującą, ile razy masa danej cząsteczki jest większa od 1/12 masy atomu węgla, oraz względna masa atomowa pierwiastka(A r) - ile razy średnia masa atomów pierwiastka chemicznego jest większa niż 1/12 masy atomu węgla.
Wartości mas atomowych i cząsteczkowych siarki są takie same; są one równe 32,059.
Alotropia i alotropowe modyfikacje siarki
Siarka występuje w postaci dwóch modyfikacji alotropowych - rombowej i jednoskośnej.
Pod normalnym ciśnieniem siarka tworzy kruche, żółte kryształy, które topią się w temperaturze 112,8 o C; gęstość wynosi 2,07 g/cm3. Jest nierozpuszczalny w wodzie, ale dość dobrze rozpuszczalny w dwusiarczku węgla, benzenie i niektórych innych cieczach. Podczas odparowywania tych cieczy z roztworu wydziela się siarka w postaci żółtych kryształów układu rombowego, w kształcie ośmiościanów, w których zwykle obcina się niektóre narożniki lub krawędzie (rys. 1). Ta modyfikacja siarki nazywa się rombową.
Ryż. 1. Alotropowe modyfikacje siarki.
Kryształy o innym kształcie uzyskuje się, jeśli stopioną siarkę powoli schładza się, a gdy częściowo się zestali, ciecz, która nie zdążyła jeszcze zestalić się, zostaje spuszczona. W tych warunkach ściany naczynia pokryte są od wewnątrz długimi, ciemnożółtymi kryształami w kształcie igieł układu jednoskośnego. Ta modyfikacja siarki nazywana jest jednoskośną. Ma gęstość 1,96 g/cm3, topi się w temperaturze 119,3 o C i jest stabilny tylko w temperaturach powyżej 96 o C.
Izotopy siarki
Wiadomo, że w przyrodzie siarka występuje w postaci czterech stabilnych izotopów 32 S, 33 S, 34 S i 36 S. Ich liczby masowe wynoszą odpowiednio 32, 33, 34 i 36. Jądro atomu izotopu siarki 32 S zawiera szesnaście protonów i szesnaście neutronów, a izotopy 33 S, 34 S i 36 S zawierają tę samą liczbę protonów, odpowiednio siedemnaście, osiemnaście i dwadzieścia neutronów.
Istnieją sztuczne izotopy siarki o liczbach masowych od 26 do 49, spośród których najbardziej stabilny jest 35 S z okresem półtrwania wynoszącym 87 dni.
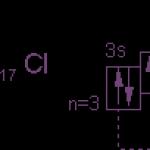
Jony siarki
Zewnętrzny poziom energii atomu siarki ma sześć elektronów, które są elektronami walencyjnymi:
1s 2 2s 2 2p 6 3s 2 3p 4 .
W wyniku interakcji chemicznych siarka może utracić swoje elektrony walencyjne, tj. być ich dawcą i zamieniać się w dodatnio naładowane jony lub przyjmować elektrony z innego atomu, tj. być ich akceptorem i zamieniać się w ujemnie naładowane jony:
S 0-6e → S 6+ ;
S 0-4e → S 4+ ;
S 0-4e → S 2+ ;
S o +2e → S 2- .
Cząsteczka i atom siarki
Cząsteczka siarki jest jednoatomowa - S. Oto kilka właściwości charakteryzujących atom i cząsteczkę siarki:
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenia | Jaka masa siarki będzie potrzebna, aby otrzymać siarczek glinu Al 2 S 3 o masie 30 g? W jakich warunkach można otrzymać ten siarczek z prostych substancji? |
| Rozwiązanie | Zapiszmy równanie reakcji wytwarzania siarczku siarki: 2Al + 3S = Al 2 S 3. Obliczmy ilość substancji siarczku glinu (masa molowa - 150 g/mol): n(Al2S3) = m(Al2S3) / M(Al2S3); n(Al 2 S 3) = 30 / 150 = 0,2 mol. Zgodnie z równaniem reakcji n(Al 2 S 3): n(S) = 1:3 oznacza to: n(S) = 3 × n(Al2S3); n(S) = 3 × 0,2 = 0,6 mol. Wtedy masa siarki będzie równa (masa molowa - 32 g/mol): m(S) = n(S) × M(S); Względna masa atomowa (A r) - wielkość bezwymiarowa równa stosunkowi średniej masy atomu pierwiastka (z uwzględnieniem procentowej zawartości izotopów w przyrodzie) do 1/12 masy atomu 12 C. Średnia bezwzględna masa atomowa (M) równa względnej masie atomowej razy amu. Ar(Mg) = 24,312 m(Mg) = 24,312 1,66057 10 -24 = 4,037 10 -23 g Względna masa cząsteczkowa (Pan) - wielkość bezwymiarowa pokazująca, ile razy masa cząsteczki danej substancji jest większa od 1/12 masy atomu węgla 12 C. M g = m g / (1/12 m a (12 C)) Pan - masa cząsteczki danej substancji; m a (12 C) - masa atomu węgla 12 C. M g = S ZA g (e). Względna masa cząsteczkowa substancji jest równa sumie względnych mas atomowych wszystkich pierwiastków, biorąc pod uwagę wskaźniki. Przykłady. M sol (B 2 O 3) = 2 ZA r (B) + 3 ZA r (O) = 2 11 + 3 16 = 70 M g (KAl(SO 4) 2) = 1 A r (K) + 1 A r (Al) + 1 2 A r (S) + 2 4 A r (O) = Bezwzględna masa cząsteczkowa równa względnej masie cząsteczkowej pomnożonej przez amu. Liczba atomów i cząsteczek w zwykłych próbkach substancji jest bardzo duża, dlatego przy charakteryzowaniu ilości substancji stosuje się specjalną jednostkę miary - mol. Ilość substancji, mol . Oznacza pewną liczbę elementów strukturalnych (cząsteczek, atomów, jonów). WyznaczonyN , mierzone w molach. Mol to ilość substancji zawierająca tyle cząstek, ile jest atomów w 12 g węgla. Liczba Avogadro (N.A ). Liczba cząstek w 1 molu dowolnej substancji jest taka sama i wynosi 6,02 10 23. (Stała Avogadra ma wymiar - mol -1). Przykład. Ile cząsteczek znajduje się w 6,4 g siarki? Masa cząsteczkowa siarki wynosi 32 g/mol. Określamy ilość g/mol substancji w 6,4 g siarki: N ( s) = m(s)/M(s ) = 6,4 g / 32 g/mol = 0,2 mol Określmy liczbę jednostek strukturalnych (cząsteczek) za pomocą stałej Avogadro N A N(s) = N (S)N A = 0,2 6,02 10 23 = 1,2 10 23 Masa cząsteczkowa pokazuje masę 1 mola substancji (oznaczoną jakoM). M = m / N Masa molowa substancji jest równa stosunkowi masy substancji do odpowiedniej ilości substancji. Masa molowa substancji jest liczbowo równa jej względnej masie cząsteczkowej, przy czym pierwsza wielkość ma wymiar g/mol, a druga jest bezwymiarowa. M = N A m (1 cząsteczka) = N A M g 1 amu = (N A 1 amu) M g = M g Oznacza to, że jeśli masa określonej cząsteczki wynosi np. 80 amu. ( TAK 3 ), wówczas masa jednego mola cząsteczek jest równa 80 g. Stała Avogadra jest współczynnikiem proporcjonalności zapewniającym przejście od zależności molekularnych do molowych. Wszystkie stwierdzenia dotyczące cząsteczek zachowują ważność dla moli (z zastąpieniem, jeśli to konieczne, amu przez g).Na przykład równanie reakcji: 2 Na + Cl 2 2 NaCl , oznacza, że dwa atomy sodu reagują z jedną cząsteczką chloru lub, co jest tym samym, dwa mole sodu reagują z jednym molem chloru. NawigacjaRównież polecamy |