Vlastnosti prvkov VII (17) skupiny hlavnej podskupiny. Siedma skupina prvkov periodickej tabuľky Charakteristika prvkov 7. skupiny hlavnej podskupiny
Prvky zahrnuté v skupine VII periodickej tabuľky sú rozdelené do dvoch podskupín: hlavná - halogénová podskupina - a sekundárna - mangánová podskupina. Vodík je umiestnený v rovnakej skupine, hoci jeho atóm má jeden elektrón na vonkajšej valenčnej úrovni a mal by byť umiestnený v skupine I. Vodík má však veľmi málo spoločného s prvkami hlavnej podskupiny – alkalickými kovmi, ako aj s prvkami sekundárnej podskupiny – meďou, striebrom a zlatom. Zároveň, podobne ako halogény, pridáva elektrón v reakciách s aktívnymi kovmi a vytvára hydridy, ktoré majú určitú podobnosť s halogenidmi.
Podskupina halogénov zahŕňa fluór, chlór, bróm, jód a astatín. Prvé štyri prvky sa nachádzajú v prírode, posledný sa získava umelo, a preto bol skúmaný oveľa menej ako ostatné halogény. Slovo halogén znamená soľotvorný. Prvky podskupiny dostali tento názov kvôli ľahkosti, s akou reagujú s mnohými kovmi a tvoria soli.
Všetky halogény majú štruktúru vonkajšieho plášťa s2p5. Preto ľahko prijímajú elektrón a vytvárajú stabilný elektrónový obal vzácneho plynu (s2р6). Fluór má najmenší atómový polomer v podskupine; pre zvyšok sa zvyšuje v sérii F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов к электрону. Галогены - очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром - иод из иодидов.
Zo všetkých halogénov len fluór, ktorý je v období II, nemá nenaplnenú hladinu d. Z tohto dôvodu nemôže mať viac ako jeden nespárovaný elektrón a vykazuje len valenciu -1. V atómoch iných halogénov nie je hladina d naplnená, čo im umožňuje mať rôzny počet nepárových elektrónov a prejavovať valencie -1, +1, +3, +5 a +7 pozorované v kyslíkových zlúčeninách chlór, bróm a jód.
Podskupina mangánu zahŕňa mangán, technécium a rénium. Na rozdiel od halogénov majú prvky mangánovej podskupiny iba dva elektróny na vonkajšej elektrónovej úrovni, a preto nevykazujú schopnosť pripájať elektróny za vzniku záporne nabitých iónov.
NEÚPLNÉ STREDNÉ VZDELANIE v Ruskej federácii, etapa získania ukončeného stredoškolského vzdelania; vedomosti získané na strednej škole. Tí, ktorí ukončili 8. (9.) ročník, pokračujú vo vzdelávaní na strednej škole alebo v zariadeniach odborného vzdelávania.
Jevgenij Petrovič ČELYŠEV (nar. 1921), ruský literárny kritik, akademik Ruskej akadémie vied (1991; akademik Akadémie vied ZSSR od roku 1987). Pracuje na problémoch indickej literatúry.
ENTHUSIASM (gr. entuziazmus), inšpirácia, nadšenie v procese dosiahnutia cieľa.
9 Ž 1s 2 2s 2 2p 5
17 Cl 3s 2 3p 5
35 Br 3d 10 4s 2 4p 5
53 I 4d 10 5s 2 5p 5
85 O 4f 14 5d 10 6s 2 6p 5
5 prvkov hlavnej podskupiny skupiny VII má spoločný názov skupiny „halogény“ (Hal), čo znamená „vyrábajúci soľ“.
Podskupina halogénov zahŕňa fluór, chlór, bróm, jód a astatín (astatín je rádioaktívny prvok, málo preskúmaný). Toto sú p-prvky skupiny periodického systému D.I. Mendelejev. Na vonkajšej energetickej úrovni majú ich atómy 7 elektrónov ns 2 np 5. To vysvetľuje spoločné vlastnosti ich vlastností.
Vlastnosti prvkov podskupiny halogénov
Ľahko pridávajú každý jeden elektrón, pričom vykazujú oxidačný stav -1. Halogény majú tento stupeň oxidácie v zlúčeninách s vodíkom a kovmi.
Atómy halogénov však môžu okrem fluóru vykazovať aj kladné oxidačné stavy: +1, +3, +5, +7. Možné hodnoty oxidačných stavov sú vysvetlené elektrónovou štruktúrou, ktorá pre atómy fluóru môže byť znázornená diagramom
Ako najviac elektronegatívny prvok môže fluór prijať iba jeden elektrón na 2p podúroveň. Má jeden nepárový elektrón, takže fluór môže byť iba monovalentný a oxidačný stav je vždy -1.
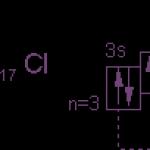
Elektrónovú štruktúru atómu chlóru vyjadruje diagram:

Atóm chlóru má jeden nepárový elektrón v podúrovni 3p a normálny (neexcitovaný) stav chlóru je monovalentný. Ale keďže chlór je v tretej perióde, má ďalších päť orbitálov 3. podúrovne, do ktorých sa zmestí 10 elektrónov.
V excitovanom stave atómu chlóru sa elektróny pohybujú z podúrovne 3p a 3s do podúrovne 3d (znázornené šípkami v diagrame). Oddelenie (párovanie) elektrónov nachádzajúcich sa v rovnakom orbitále zvyšuje valenciu o dve jednotky. Je zrejmé, že chlór a jeho analógy (okrem fluóru) môžu vykazovať len nepárne premenné mocenstvo 1, 3, 5, 7 a zodpovedajúce kladné oxidačné stavy. Fluór nemá žiadne voľné orbitály, čo znamená, že počas chemických reakcií nedochádza k separácii párových elektrónov v atóme. Preto pri zvažovaní vlastností halogénov je vždy potrebné brať do úvahy vlastnosti fluóru a zlúčenín.
Vodné roztoky vodíkových zlúčenín halogénov sú kyseliny: HF - fluorovodíková (fluorovodíková), HCl - chlorovodíková (chlorovodíková), HBr - bromovodíková, HI - jodovodíková.
Identická štruktúra vonkajšej elektronickej vrstvy (ns 2 np 5) určuje veľkú podobnosť prvkov.
Jednoduché látky - nekovy F 2 (plyn), Cl 2 (plyn), Br 2 (l), l 2 (tuhá látka).
Pri vytváraní kovalentných väzieb halogény najčastejšie využívajú jeden nepárový p-elektrón dostupný v neexcitovanom atóme, ktorý má B = I.
Valenčné stavy atómov CI, Br, I.
Vytváraním väzieb s atómami viac elektronegatívnych prvkov môžu atómy chlóru, brómu a jódu prechádzať zo základného valenčného stavu do excitovaných, čo je sprevádzané prechodom elektrónov na voľné orbitály d-podúrovne. V tomto prípade sa zvyšuje počet nepárových elektrónov, v dôsledku čoho môžu atómy CI, Br, I tvoriť väčší počet kovalentných väzieb:
Rozdiel medzi F a inými halogénmi
V atóme F sú valenčné elektróny v 2. energetickej hladine, ktorá má len s- a p-podúrovne. To vylučuje možnosť prechodu atómov F do excitovaných stavov, preto fluór vo všetkých zlúčeninách vykazuje konštantu B rovnajúcu sa I. Okrem toho je fluór elektronegatívnym prvkom, v dôsledku čoho má aj konštantu c. O. -1.
Najdôležitejšie zlúčeniny halogénov
I. Halogenidy vodíka HHal.
II Halogenidy kovov (soli halogenovodíkových kyselín) sú najpočetnejšie a najstabilnejšie halogénové zlúčeniny
III. Organohalogénové zlúčeniny
IV. Látky obsahujúce kyslík:
Nestabilné oxidy, z ktorých existenciu 6 oxidov možno považovať za spoľahlivú (Cl 2 O, ClO 2, Cl 2 O 7, Br 2 O, BrO 2, I 2 O 5);
Nestabilné oxokyseliny, z ktorých sú izolované len 3 kyseliny ako jednotlivé látky (HClO 4, HlO 3, HlO 4);
Soli oxokyselín, hlavne chloritany, chlorečnany a chloristany.
10221 0
Skupina 17 zahŕňa F, Cl, Br, I, At (tabuľky 1 a 2). Slovo halogén („halo“ + „gen“) znamená „soľotvorný“. Všetky prvky sú nekovové. Vo vonkajšom obale majú 7 elektrónov. Kvôli ich vysokej elektronegativite a reaktivite sa v prírode nenachádzajú vo voľnej forme. Vďaka ľahkému pridaniu elektrónu tvoria halogenidové ióny, a preto existujú vo forme dvojatómových molekúl. Atómy v molekulách sú spojené kovalentnou väzbou v dôsledku zdieľania páru elektrónov, jedného z atómu. Halogénové molekuly sú držané pohromade slabými van der Waalsovými silami, čo vysvetľuje ich vysokú prchavosť.
Stôl 1 . Niektoré fyzikálne a chemické vlastnosti kovov 17. skupiny
|
|
názov |
Týka sa, o. hmotnosť |
Elektronický vzorec |
Polomer, pm |
Hlavné izotopy (%) |
|
|
Fluór Fluór [z lat. fluere - prúdiť] |
kovalentná 58 | |||||
|
Chlór Chlór [z gréc. chloros - zelenkastý] |
kovalentné 99 | |||||
|
Bróm Bróm [z gréc. bromos - smrad] |
3d 10 4s 2 4p 5 |
Kovalentná 114,2 |
79 Vg* (50,69) |
|||
|
Jód Jód [z gréc. jódy - fialová] |
4d 10 5s 2 5p 5 |
Kovalentná 133 | ||||
|
Astatín Astatín [z gréc. Astatos – nestabilný] |
4f 14 5d 10 6s 2 6p 5 |
Všetky halogény sú jedovaté, majú charakteristický štipľavý zápach a farbu, ktorej intenzita sa smerom k spodnej časti skupiny zvyšuje. Túto skupinu tvoria najreaktívnejšie prvky periodickej tabuľky. Atómové a iónové polomery halogénov, ako aj dĺžky väzieb v molekulách sa zväčšujú smerom k spodnej časti skupiny v periodickej tabuľke. Naopak, energia disociácie väzby a jej pevnosť klesá, s výnimkou fluóru.
Halogenidy alkalických kovov (skupina 1) sú zlúčeniny iónového typu. V halogenidoch kovov alkalických zemín (skupina 2) sú okrem iónových aj zlúčeniny čiastočne kovalentného typu. Ako sa pohybujete zľava doprava po perióde, halogenidy prvkov sa stávajú kovalentnými. Kovalentná povaha halogenidov sa tiež zvyšuje, keď sa človek pohybuje nadol v skupine. Okrem toho, ak kov môže existovať v niekoľkých oxidačných stavoch, potom jeho väzba s halogenidom v najnižšom z nich je iónovej povahy a v najvyššom je kovalentná. Iónové aj kovalentné halogenidy dvojmocných kovov majú tendenciu kryštalizovať do vrstvených mriežok. Výnimkou je CCl 2 s polymérnou štruktúrou. Halogenidové ióny sú ligandy v mnohých komplexných iónoch, ktoré vytláčajú menej silné ligandy, ako je voda.
Halogenidy striebra sú na slnečnom svetle nestabilné, rozkladajú sa na kov a halogén. Táto vlastnosť sa využíva pri čiernobielej fotografii. Najcitlivejšie na svetlo boli bromidy Ag. Hojne sa využívajú halogenovodíky, ktoré patria medzi najznámejšie silné kyseliny. Kyslosť ich vodných roztokov sa zvyšuje smerom k spodnej časti skupiny. Výnimkou je fluorovodík. Jeho vodný roztok ( kyselina fluorovodíková) má miernu kyslosť v dôsledku pevnosti väzby H - F a malá disociačná konštanta kyseliny.
Tabuľka 2 Obsah v tele, toxické (TD) a smrteľné dávky (LD) kovov 17. skupiny
|
|
V zemskej kôre (%) |
V oceáne (%) |
V ľudskom tele | ||||
|
Priemer (s telesnou hmotnosťou 70 kg) |
Krv (mg/l) |
||||||
|
TD - 20 mg, LD - 2 g |
|||||||
|
Jedovatý |
|||||||
|
TD - 3 g, LD - > 35 g |
|||||||
|
(0,43-0,58) x 10-5 |
(0,05-5) x10-5 |
TD - 2 mg, LD - 35-350 g |
|||||
|
Stopy v niektorých mineráloch |
Toxický v dôsledku rádioaktivity |
||||||
fluór (F) — z hľadiska prevalencie sa radí na 13. miesto medzi prvkami zemskej kôry, najreaktívnejší prvok, najsilnejší z priemyselne vyrábaných oxidačných činidiel. V plynnej forme má svetložltú farbu. V priemysle sa využívajú najmä jeho organické zlúčeniny, polyméry a všetky soli CaF 2 - ako tavivo v metalurgii, a AlF 3 - počas výroby Al. Veľké množstvá F 2 boli vyrobené v jadrovom priemysle na získanie U.F. 6 v procesoch obohacovania jadrového paliva.
Tesné usporiadanie atómov v molekule F vedie k silnému odpudzovaniu medzi neväzbovými elektrónmi, čo vysvetľuje oslabenie väzby v molekule. Preto fluór v elementárnom stave vo forme F 2 sa nenachádza, ale je prítomný ako fluoridový ión v kryolit Na 3 AlF 6 a kazivec (fluorit) CaF 2 .
F má vždy oxidačný stav -1. Malý kovalentný polomer umožňuje vytvárať zlúčeniny s vysokými koordinačnými číslami; Napríklad, SF 6 existuje, a S.J. 6 nemožno vytvoriť. Kovové fluoridové ióny majú malú veľkosť iónov F- spôsobuje vysoké mriežkové entalpie a termodynamickú stabilitu.
Vďaka vysokej oxidačnej schopnosti fluóru môžu halogény navzájom reagovať a vytvárať interhalogénové zlúčeniny("interhalogenidy") ClF, ClF3, BrF5, IF 7, v ktorom sa oxidačný stav ostatných halogénov mení od +1 do +7.
Po inkubácii pečene potkana s NaF absorbovaný fluór sa koncentruje v mitochondriách a jadrách hepatocytov. Je absorbovaný kostným tkanivom (zuby, kosti, chrupavka) 3-krát aktívnejšie ako krvou. F sa vylučuje hlavne obličkami. Toxický účinok fluoridových iónov je spôsobený tým, že viažu a tým inaktivujú iónové aktivátory enzýmových systémov So 2+ , Mg 2+ s tvorbou zle rozpustných fluoridov. Komplexné ióny PF - , B.F. 4 - , SiF 6 2-, vzhľadom na silu kovalentných väzieb v ich molekulách, sú biologicky neaktívne. F- inhibuje metaloproteíny.
chlór (Cl) - v prírode sa vyskytuje najmä vo forme kamennej soli NaCl. Získava sa z nej elektrolýzou Cl 2 - ťažký žltozelený plyn so štipľavým zápachom. V priemysle sa používa ako bielidlo a pri výrobe organochlórových rozpúšťadiel a polymérov. Okrem toho je široko používaný na sterilizáciu vody vo vodárňach v koncentráciách (0,6-6)x10 -5 mol/kg. Keď je však voda znečistená organickými látkami obsahujúcimi dusík, chlórovanie vody je nebezpečné, pretože atómy Cl môže nahradiť atómy H v molekulách alkánov a alkénov pri fotolytických reakciách, to znamená pri ožiarení viditeľným svetlom s vlnovou dĺžkou 200-800 nm. V tomto prípade vznikajú toxické organochlórové zlúčeniny – deriváty dioxín najmä vysoko toxický 2,3,7,8-tetrachlórdibenzo- n-dioxín (obr. 1). „Dioxíny“ vo všeobecnosti označujú polychlórované dibenzo-a-dioxíny. Všetky, dokonca aj vo veľmi nízkych koncentráciách, prudko znižujú ľudskú imunitu voči vírusovým infekciám a ovplyvňujú genetický aparát.
Ryža. 1. Dioxíny (2,3,7,8-tetrachlórdibenzo-p-dioxín)
Spojenia s O 2 (chlórový HClO,,chlórnanové“ soli; chlorid HClO 2, „chloritanové“ soli; chlórna HClO 3, „chlorečnanové“ soli; chlór HClO 4 kyseliny, chloristanové soli, ako aj ich anióny a oxidy) sú oxidačné činidlá; používajú sa ako dezinfekčné prostriedky.
Obsah chlóru v tkanivách cicavcov je blízky obsahu v morskej vode. Chloridové ióny Cl- sú takmer rovnomerne distribuované v tele živých bytostí v znateľných množstvách (od 70 do 103 mmol/l). Vylučujú sa obličkami. Kvapalný chlór spôsobuje vážne poleptanie pokožky a plynný chlór silne dráždi oči a pľúca, pričom s tkanivovým mokom vytvára kyselinu chlorovodíkovú a chlórnu. V pľúcach sa môže vyvinúť pneumónia.
bróm (Br) - hustá tmavočervená kvapalina štipľavého zápachu a ťažkých hnedých výparov. Je to jediný nekov, ktorý je pri izbovej teplote tekutý. Používa sa ako prísada do paliva, ako inhibítor horenia v ohňovzdorných materiáloch, vo farbách a pesticídoch a vo fotografii. Biologická úloha je však nedostatočne študovaná Br 2 jedovatý. Pomer Br/Cl v krvi je približne 0,01 a Br- nachádza sa najmä v plazme. Sprevádza chlór v metabolických procesoch a vylučuje sa močom.
jód (I) - tvrdý čierny lesklý nekov. Ľahko sublimuje. Používa sa ako dezinfekčný roztok alkoholu, v potravinárskych prísadách, farbivách, katalyzátoroch a vo fotografii. Patrí medzi biologicky nevyhnutné („esenciálne“) prvky a je súčasťou hormónov štítnej žľazy. Jeho nedostatok sa považuje za faktor predisponujúci k vzniku rakoviny štítnej žľazy a prsníka.
ja selektívne sa hromadí v štítnej žľaze (viac ako 80 %). jodid ja- vstúpil do tela, rýchlo sa koncentruje v žľaze, kde je jeho koncentrácia 25-500 krát vyššia ako v krvi. V štítnej žľaze sa jodid oxiduje na jód, ktorý pod vplyvom špecifického enzýmu jodiduje aromatické kruhy tyrozínu v molekulách tyreoglobulínu za vzniku lipofilných rastových hormónov - tyroxínu, jódtyronín, trijódtyronín. Jód v koncentrácii 5x10 -5 M rozpája oxidačnú fosforyláciu v mitochondriách a ľahko vytvára nerozpustné cheláty s dvakrát nabitými iónmi kovov, najmä s Mg 2+ a MP 2+. Činnosť štítnej žľazy je aktivovaná obsahom jódu hormón hypofýzy stimulujúci štítnu žľazu.
Nedostatok jódu v ľudskej potrave vedie k hypotyreóze a Gravesovej chorobe (struma). Jód sa nachádza v značnom množstve v morských riasach (hnedé riasy rodu Laminaria) vo forme mono- a dijódtyrozínu, ako aj mono- a dijódtyronínu, čo umožňuje použitie týchto rias pri ochoreniach štítnej žľazy ako prírodný zdroj hotových prekurzorov rastového hormónu.
V biogeochemických provinciách s nedostatkom jódu sa jeho soli pridávajú do kuchynskej soli, čo však neprináša pozitívne výsledky. Zistilo sa, že s nedostatkom jódu sa dá oveľa účinnejšie bojovať pridaním prírodných produktov obsahujúcich jód, najmä morských rias, do potravinárskych výrobkov, ako je napríklad chlieb. Predtým sa jód extrahoval z popola hnedých rias, teraz - zo zdrojov ropy a soli. Všimnite si, že jeden z kľúčových enzýmov metabolizmu jódu ( dejodáza), ktorý zabezpečuje homeostázu tyroxínu, patrí medzi selenoproteíny. V dôsledku toho boj proti nedostatku jódu na pozadí nedostatku Se je nezmyselná a vzhľadom na mechanizmus spätnej väzby škodlivá.
astatín (at) - rádioaktívny nekov získaný neutrónovým bombardovaním izotopu 209 Bi. Kvôli svojmu krátkemu polčasu rozpadu nebol príliš skúmaný.
Lekárska bioanorganika. G.K. Baraškov
Odoslanie dobrej práce do databázy znalostí je jednoduché. Použite nižšie uvedený formulár
Študenti, postgraduálni študenti, mladí vedci, ktorí pri štúdiu a práci využívajú vedomostnú základňu, vám budú veľmi vďační.
Uverejnené dňa http://www.allbest.ru/
Úvod
Skupina VII periodickej tabuľky prvkov zahŕňa mangán, technécium, rénium, bohrium, ako aj podľa starej nomenklatúry fluór, chlór, bróm, jód, astatín - čo sú halogény.
Prvky skupiny 7 majú 7 valenčných elektrónov. Všetky sú to strieborno-biele žiaruvzdorné kovy. V rade Mn - Tc - Re chemická aktivita klesá. Elektrická vodivosť rénia je približne 4-krát menšia ako volfrámu. Na vzduchu je kompaktný kovový mangán pokrytý tenkým filmom oxidu, ktorý ho chráni pred ďalšou oxidáciou aj pri zahriatí. Naopak, v jemne rozdrvenom stave celkom ľahko oxiduje.
Na vonkajšej energetickej úrovni majú halogény 7 elektrónov a sú silnými oxidačnými činidlami. Pri interakcii s kovmi vzniká iónová väzba a vznikajú soli. Pri interakcii s viacerými elektronegatívnymi prvkami môžu halogény (okrem fluóru) tiež vykazovať redukčné vlastnosti až do najvyššieho oxidačného stavu +7.
Technécium a bohrium sú rádioaktívne s pomerne krátkym polčasom rozpadu, preto sa v prírode nevyskytujú. Mangán je jedným z bežných prvkov, ktorý tvorí 0,03 % z celkového počtu atómov v zemskej kôre.
Pokiaľ ide o halogény, sú vysoko reaktívne, a preto sa v prírode zvyčajne nachádzajú vo forme zlúčenín. Ich prevalencia v zemskej kôre klesá so zvyšujúcim sa polomerom atómu od fluóru po jód.
halogénový prvok astatín mangán
1. Siedmy1. skupina periodickej tabuľky
1,1 Gláva podskupina sedem skupina. Halogény
Hlavná podskupina skupiny VII zahŕňa prvky fluór, chlór, bróm, jód a astatín.
Halogény (z gréckeho ?lt - soľ a gEnpt - narodenie, pôvod; niekedy sa používa zastaraný názov halogény) - chemické prvky skupiny VII periodickej tabuľky chemických prvkov D. I. Mendelejeva.
Reagujú takmer so všetkými jednoduchými látkami, okrem niektorých nekovov. Všetky halogény sú energetické oxidačné činidlá, a preto sa v prírode vyskytujú iba vo forme zlúčenín. So zvyšujúcim sa atómovým číslom chemická aktivita halogénov klesá, chemická aktivita halogenidových iónov F ? ,Cl? ,Br? ,ja? ,O? klesá.
Všetky halogény sú nekovy. Na vonkajšej energetickej úrovni je 7 elektrónov silných oxidačných činidiel. Pri interakcii s kovmi vzniká iónová väzba a vznikajú soli. Pri interakcii s viacerými elektronegatívnymi prvkami môžu halogény (okrem fluóru) tiež vykazovať redukčné vlastnosti až do najvyššieho oxidačného stavu +7.
Ako bolo uvedené vyššie, halogény majú vysokú reaktivitu, preto sa v prírode zvyčajne nachádzajú vo forme zlúčenín.
Ich prevalencia v zemskej kôre klesá so zvyšujúcim sa polomerom atómu od fluóru po jód. Množstvo astatínu v zemskej kôre sa meria v gramoch a ununseptium v prírode chýba. Fluór, chlór, bróm a jód sa vyrábajú v priemyselnom meradle, pričom objemy výroby chlóru sú výrazne vyššie ako u ostatných troch stabilných halogénov.
V prírode sa tieto prvky vyskytujú predovšetkým ako halogenidy (s výnimkou jódu, ktorý sa tiež vyskytuje ako jodičnan sodný alebo draselný v ložiskách dusičnanov alkalických kovov). Pretože veľa chloridov, bromidov a jodidov je rozpustných vo vode, tieto anióny sú prítomné v oceánoch a prírodných soľných roztokoch. Hlavným zdrojom fluóru je fluorid vápenatý, ktorý je veľmi málo rozpustný a nachádza sa v sedimentárnych horninách (ako fluorit CaF 2).
Hlavným spôsobom získania jednoduchých látok je oxidácia halogenidov. Vysoké kladné štandardné elektródové potenciály Eo (F2/F?) = +2,87 V a Eo (Cl2/Cl?) = +1,36 V ukazujú, že oxidujú ióny F? a Cl? možné len so silnými oxidačnými činidlami. V priemysle sa používa iba elektrolytická oxidácia. Pri výrobe fluóru nie je možné použiť vodný roztok, pretože voda oxiduje pri oveľa nižšom potenciáli (+1,32 V) a výsledný fluór by rýchlo reagoval s vodou. Fluór prvýkrát získal v roku 1886 francúzsky chemik Henri Moissan elektrolýzou roztoku hydrofluoridu draselného KHF 2 v bezvodej kyseline fluorovodíkovej.
V priemysle sa chlór vyrába hlavne elektrolýzou vodného roztoku chloridu sodného v špeciálnych elektrolyzéroch. V tomto prípade sa vyskytujú nasledujúce reakcie:
polovičná reakcia na anóde:
polovičná reakcia na katóde:
Oxidácia vody na anóde je potlačená použitím elektródového materiálu, ktorý má vyššie prepätie voči O2 ako voči Cl2 (takýmto materiálom je najmä RuO2).
V moderných elektrolyzéroch sú katódové a anódové priestory oddelené polymérnou iónomeničovou membránou. Membrána umožňuje prechod katiónov Na + z anódového priestoru do katódového priestoru. Prechod katiónov zachováva elektrickú neutralitu v oboch častiach elektrolyzéra, pretože pri elektrolýze sa z anódy odstraňujú negatívne ióny (premena 2Cl ? na Cl 2) a akumulujú sa na katóde (tvorba OH ?). Pohybuje sa OH ? v opačnom smere by tiež mohol zachovať elektrickú neutralitu, ale OH ión? by reagoval s Cl 2 a negoval by celý výsledok.
Bróm sa získava chemickou oxidáciou bromidového iónu nachádzajúceho sa v morskej vode. Podobný proces sa používa na získanie jódu z prírodných soľaniek bohatých na I? . V oboch prípadoch sa ako oxidačné činidlo používa chlór, ktorý má silnejšie oxidačné vlastnosti a vzniknutý Br 2 a I 2 sa z roztoku odstraňujú prúdom vzduchu.
Tabuľka 1, Niektoré vlastnostihalogény.
1.2 Fluór
Fluór(lat. Fluorum), F, chemický prvok skupiny VII periodického systému Mendelejeva, patrí medzi halogény, atómové číslo 9, atómová hmotnosť 18,998403; za normálnych podmienok (0 °C; 0,1 Mn/m2 alebo 1 kgf/cm2) - svetložltý plyn s prenikavým zápachom.
Prírodný fluór pozostáva z jedného stabilného izotopu 19F. Množstvo izotopov bolo získaných umelo, najmä: 16F s polčasom rozpadu T ½< 1 сек, 17 F (T Ѕ = 70 сек) , 18 F (T Ѕ = 111 мин) , 20 F (T Ѕ = 11,4 сек) , 21 F (T Ѕ = 5 сек).
Historický odkaz. Prvá zlúčenina fluóru - fluorit (kazivec) CaF 2 - bola opísaná koncom 15. storočia pod názvom "fluór" (z latinského fluo - tok, vďaka vlastnosti CaF 2 vytvárať viskózne trosky hutníckej výrobnej kvapaliny -tečúca). V roku 1771 K. Scheele získal kyselinu fluorovodíkovú. Voľný fluór izoloval A. Moissan v roku 1886 elektrolýzou kvapalného bezvodého fluorovodíka obsahujúceho prímes kyslého fluoridu draselného KHF 2.
Fluórová chémia sa začala rozvíjať v 30. rokoch 20. storočia, obzvlášť rýchlo počas druhej svetovej vojny v rokoch 1939-45 a po nej v súvislosti s potrebami jadrového priemyslu a raketovej techniky. Názov "Fluór" (z gréckeho phthoros - zničenie, smrť), ktorý navrhol A. Ampere v roku 1810, sa používa iba v ruštine; V mnohých krajinách je akceptovaný názov "fluór".
Distribúcia fluóru v prírode. Priemerný obsah fluóru v zemskej kôre (clarke) je 6,25·10 -2 % hmotnosti; v kyslých vyvrelých horninách (žuly) je to 8·10 -2 %, v zásaditých horninách - 3,7·10 -2 %, v ultrabázických horninách - 1·10 -2 %. Fluór je prítomný v sopečných plynoch a termálnych vodách. Najdôležitejšie zlúčeniny fluóru sú fluorit, kryolit a topaz. Celkovo je známych viac ako 80 minerálov obsahujúcich fluór. Zlúčeniny fluóru sa nachádzajú aj v apatitoch, fosforitoch a iných. Fluór je dôležitým biogénnym prvkom. V histórii Zeme boli zdrojom fluóru vstupujúceho do biosféry produkty sopečných erupcií (plyny atď.).
Fyzikálne vlastnosti fluóru. Plynný fluór má hustotu 1,693 g / l (0 ° C a 0,1 Mn / m2 alebo 1 kgf / cm2), kvapalina - 1,5127 g / cm3 (pri teplote varu); tpl -219,61 °C; bod varu -188,13 °C. Molekula fluóru pozostáva z dvoch atómov (F 2); pri 1000 °C disociuje 50 % molekúl, disociačná energia je asi 155 kJ/mol (37 kcal/mol). Fluór je slabo rozpustný v kvapalnom fluorovodíku; rozpustnosť 2,5-10-3 g v 100 g HF pri -70 °C a 0,4-10-3 g pri -20 °C; v kvapalnej forme, neobmedzene rozpustný v kvapalnom kyslíku a ozóne.
Chemické vlastnosti fluóru. Konfigurácia vonkajších elektrónov atómu fluóru je 2s 2 2p 5. V zlúčeninách vykazuje oxidačný stav -1. Kovalentný polomer atómu je 0,72E, iónový polomer je 1,3ЗЕ. Elektrónová afinita 3,62 eV, ionizačná energia (F > F+) 17,418 eV. Vysoké hodnoty elektrónovej afinity a ionizačnej energie vysvetľujú silnú elektronegativitu atómu fluóru, najväčšiu spomedzi všetkých ostatných prvkov. Vysoká reaktivita fluóru určuje exotermickú povahu fluorácie, ktorá je zase určená anomálne nízkou hodnotou disociačnej energie molekuly fluóru a veľkými hodnotami väzbovej energie atómu fluóru s inými atómami. Priama fluoridácia má reťazový mechanizmus a môže ľahko viesť k horeniu a výbuchu. Fluór reaguje so všetkými prvkami okrem hélia, neónu a argónu. Interaguje s kyslíkom v žiarivom výboji, pričom pri nízkych teplotách vytvára fluoridy kyslíka O 2 F 2, O 3 F 2 a iné. Reakcie fluóru s inými halogénmi sú exotermické, čo vedie k tvorbe interhalogénových zlúčenín. Chlór interaguje s fluórom pri zahriatí na 200-250 °C, čím vzniká monofluorid chlóru ClF a fluorid chlóru ClF 3. Známy je aj ClF 5 získaný fluoridáciou ClF 3 pri vysokej teplote a tlaku 25 Mn/m2 (250 kgf/cm2 ).Bróm a jód sa vznietia vo fluórovej atmosfére pri bežných teplotách a možno získať BrF 3, BrF 5, IF 3, IF 2. Fluór priamo reaguje s kryptónom, xenónom a radónom za vzniku zodpovedajúcich fluoridov (napríklad XeF 4 XeF6, KrF2 Xenónové oxyfluoridy sú tiež známe.
Interakcia fluóru so sírou je sprevádzaná uvoľňovaním tepla a vedie k tvorbe mnohých fluoridov síry. Selén a telúr tvoria vyššie fluoridy SeF 6 a TeF 6 . Fluór a vodík reagujú so spaľovaním; tým vzniká fluorovodík. Ide o radikálnu reakciu rozvetvenia reťazca:
HF* + H2 = HF + H2*; H2* + F2 = HF + H + F
(kde HF* a H2* sú molekuly vo vibračne excitovanom stave); reakcia sa využíva v chemických laseroch. Fluór reaguje s dusíkom iba pri elektrickom výboji. Drevené uhlie sa pri interakcii s fluórom vznieti pri bežných teplotách; grafit s ním pri silnom zahriatí reaguje a je možný vznik tuhého fluoridu grafitu (CF) X alebo plynných perfluórovaných uhľovodíkov CF 4, C 2 F 6 a iných. Fluór v chlade reaguje s bórom, kremíkom, fosforom a arzénom za vzniku zodpovedajúcich fluoridov.
Fluór sa energicky spája s väčšinou kovov; alkalické kovy a kovy alkalických zemín sa zapália v atmosfére fluóru za studena, Bi, Sn, Ti, Mo, W - pri miernom zahriatí. Hg, Pb, U, V reagujú s fluórom pri izbovej teplote, Pt - pri tmavočervenej teplote. Keď kovy reagujú s fluórom, zvyčajne vznikajú vyššie fluoridy, napríklad UF 6, MoF 6, HgF 2. Niektoré kovy (Fe, Cu, Al, Ni, Mg, Zn) reagujú s fluórom a vytvárajú ochranný film fluoridov, ktorý bráni ďalšej reakcii.
Pri interakcii fluóru s oxidmi kovov v chlade vznikajú fluoridy kovov a kyslík; Je tiež možná tvorba oxyfluoridov kovov (napríklad Mo02F2). Nekovové oxidy buď pridávajú fluór, napríklad SO 2 + F 2 = SO 2 F 2, alebo je v nich kyslík nahradený fluórom, napríklad SiO 2 + 2F 2 = SiF 4 + O 2. Sklo reaguje s fluórom veľmi pomaly; v prítomnosti vody reakcia prebieha rýchlo. Voda interaguje s fluórom: 2H20 + 2F2 = 4HF + 02; v tomto prípade tiež vzniká OF 2 a peroxid vodíka H 2 O 2. Oxidy dusíka NO a NO2 ľahko pridávajú fluór za vzniku nitrozylfluoridu FNO a nitrilfluoridu FNO2. Oxid uhoľnatý pridáva fluór pri zahrievaní za vzniku karbonylfluoridu:
CO + F2 = COF2.
Hydroxidy kovov reagujú s fluórom za vzniku fluoridu kovu a kyslíka, napr.
2Ba(OH)2 + 2F2 = 2BaF2 + 2H20 + 02.
Vodné roztoky NaOH a KOH reagujú s fluórom pri 0 °C za vzniku OF2.
Kovové alebo nekovové halogenidy reagujú s fluórom v chlade, pričom fluór nahrádza všetky halogény.
Sulfidy, nitridy a karbidy sú ľahko fluorované. Hydridy kovov tvoria za studena fluorid kovu a HF s fluórom; amoniak (v pare) - N 2 a HF. Fluór nahrádza vodík v kyselinách alebo kovoch v ich soliach, napríklad HNO 3 (alebo NaNO 3) + F 2 = FNO 3 + HF (alebo NaF); v ťažších podmienkach fluór vytláča kyslík z týchto zlúčenín, pričom vzniká napríklad sulfurylfluorid
Na2S04 + 2F2 = 2NaF + S02F2 + O2.
Uhličitany alkalických kovov a kovov alkalických zemín reagujú s fluórom pri bežných teplotách; tým vzniká zodpovedajúci fluorid, C02 a O2.
Fluór prudko reaguje s organickými látkami.
Získanie fluóru. Zdrojom na výrobu fluóru je fluorovodík, ktorý sa získava najmä buď pôsobením kyseliny sírovej H 2 SO 4 · na fluorit CaF 2, alebo spracovaním apatitov a fosforitov. Výroba fluóru sa uskutočňuje elektrolýzou taveniny kyslého fluoridu draselného KF-(1,8-2,0)HF, ktorý vzniká nasýtením taveniny KF-HF fluorovodíkom na obsah 40-41 % HF. Materiál pre elektrolyzér je zvyčajne oceľ; elektródy - uhlíková anóda a oceľová katóda. Elektrolýza sa uskutočňuje pri 95-100 °C a napätí 9-11 V; Výstupný prúd fluóru dosahuje 90-95%. Výsledný fluór obsahuje až 5 % HF, ktorý sa odstráni zmrazením a následnou absorpciou fluoridom sodným. Fluór sa skladuje v plynnom stave (pod tlakom) a v kvapalnej forme (pri chladení tekutým dusíkom) v zariadeniach vyrobených z niklu a zliatin na jeho báze (Monel metal), medi, hliníka a jeho zliatin, mosadze, nehrdzavejúcej ocele.
Aplikácia fluóru. Plynný fluór sa používa na fluoráciu UF 4 na UF 6, na izotopovú separáciu uránu, ako aj na výrobu fluoridu chloričitého ClF 3 (fluoračné činidlo), fluoridu sírového SF 6 (plynný izolant v elektrotechnickom priemysle), fluoridy kovov (napríklad W a V). Kvapalný fluór je okysličovadlo pre raketové palivá.
Široko používané sú početné zlúčeniny fluóru - fluorovodík, fluorid hlinitý, silikofluoridy, kyselina fluórsulfónová (rozpúšťadlo, katalyzátor, činidlo na výrobu organických zlúčenín obsahujúcich skupinu - SO 2 F), BF 3 (katalyzátor), organofluórové zlúčeniny a iné.
Bezpečnostné opatrenia. Fluór je toxický, jeho maximálna prípustná koncentrácia vo vzduchu je približne 2,10 -4 mg/l a maximálna povolená koncentrácia pri expozícii nie dlhšej ako 1 hodinu je 1,5,10 -3 mg/l.
Fluorid v tele. Fluór je neustále obsiahnutý v živočíšnych a rastlinných tkanivách; mikroelement Vo forme anorganických zlúčenín sa nachádza najmä v kostiach zvierat a ľudí - 100-300 mg/kg; V zuboch je najmä veľa fluoridu. Kosti morských živočíchov sú bohatšie na fluór v porovnaní s kosťami suchozemských živočíchov. Do organizmu zvierat a ľudí sa dostáva najmä s pitnou vodou, v ktorej je optimálny obsah fluóru 1-1,5 mg/l. Pri nedostatku fluoridu vzniká človeku zubný kaz a pri zvýšenom príjme - fluoróza. Vysoké koncentrácie fluórových iónov sú nebezpečné pre ich schopnosť inhibovať množstvo enzymatických reakcií, ako aj viazať biologicky dôležité prvky. (P, Ca, Mg a iné), narúšajúc ich rovnováhu v organizme. Organické deriváty fluoridu sa nachádzajú len v niektorých rastlinách (napríklad v juhoafrickom Dichapetalum cymosum). Hlavnými z nich sú deriváty kyseliny fluorooctovej, toxické pre ostatné rastliny aj živočíchy. Bola preukázaná súvislosť medzi metabolizmom fluoridov a tvorbou kostného tkaniva kostry a najmä zubov.
Otrava fluórom je možná medzi pracovníkmi v chemickom priemysle, pri syntéze zlúčenín obsahujúcich fluór a pri výrobe fosfátových hnojív. Fluorid dráždi dýchacie cesty a spôsobuje popáleniny kože. Pri akútnej otrave dochádza k podráždeniu slizníc hrtana a priedušiek, očí, slineniu a krvácaniu z nosa; v závažných prípadoch - pľúcny edém, poškodenie centrálneho nervového systému a iné; v chronických prípadoch - konjunktivitída, bronchitída, pneumónia, pneumoskleróza, fluoróza. Charakteristické sú kožné lézie, ako je ekzém. Prvá pomoc: výplach očí vodou, pri popáleninách kože - výplach 70% alkoholom; pri inhalačnej otrave – vdýchnutí kyslíka. Prevencia: dodržiavanie bezpečnostných predpisov, nosenie špeciálneho oblečenia, pravidelné lekárske prehliadky, zaradenie vápnika a vitamínov do stravy.
1.3 Chlór
Chlór(lat. Chlorum), Cl, chemický prvok skupiny VII periodického systému Mendelejeva, atómové číslo 17, atómová hmotnosť 35,453; patrí do skupiny halogénov. Za normálnych podmienok (0°C, 0,1 Mn/m2 alebo 1 kgf/cm2) je to žltozelený plyn s ostrým dráždivým zápachom. Prírodný chlór sa skladá z dvoch stabilných izotopov: 35 Cl (75,77 %) a 37 Cl (24,23 %). Rádioaktívne izotopy s hmotnostnými číslami 31-47 boli umelo získané, najmä: 32, 33, 34, 36, 38, 39, 40 s polčasmi rozpadu (TS) 0,31; 2,5; 1,56 s; 3,1·105 rokov; 37,3, 55,5 a 1,4 min. 36Cl a 38Cl sa používajú ako izotopové indikátory.
Historický odkaz. Chlór prvýkrát získal v roku 1774 K. Scheele reakciou kyseliny chlorovodíkovej s pyroluzitom MnO 2 . Avšak až v roku 1810 G. Davy zistil, že chlór je prvok a pomenoval ho chlór (z gréckeho chloros - žltozelený). V roku 1813 J. L. Gay-Lussac navrhol pre tento prvok názov Chlór.
Distribúcia chlóru v prírode. Chlór sa v prírode vyskytuje iba vo forme zlúčenín. Priemerný obsah chlóru v zemskej kôre (clarke) je 1,7·10 -2 % hm., v kyslých vyvrelých horninách - granitoch a iných - 2,4·10 -2, v zásaditých a ultrabázických horninách 5·10 -3. Hlavnú úlohu v histórii chlóru v zemskej kôre zohráva vodná migrácia. Vo forme Cl iónu sa nachádza vo Svetovom oceáne (1,93 %), podzemných soľankách a slaných jazerách. Počet vlastných minerálov (hlavne prírodných chloridov) je 97, pričom hlavným je halit NaCl (kamenná soľ). Známe sú aj veľké ložiská chloridov draselných a horečnatých a zmesné chloridy: sylvinit KCl, sylvinit (Na,K)Cl, karnalit KCl MgCl 2 6H 2 O, kainit KCl MgSO 4 3H 2 O, bischofit MgCl 2 6H 2 O V histórii Zeme mal veľký význam prísun HCl obsiahnutý v sopečných plynoch do vrchných častí zemskej kôry.
Fyzikálne vlastnosti chlóru. Chlór má bod varu -34,05°C, bod topenia -101°C. Hustota plynného chlóru za normálnych podmienok je 3,214 g/l; nasýtená para pri 0 °C 12,21 g/l; kvapalný chlór s teplotou varu 1,557 g/cm3; pevný chlór pri -102 °C 1,9 g/cm3. Tlak nasýtených pár chlóru pri 0 °C 0,369; pri 25 °C 0,772; pri 100 °C 3,814 Mn/m2, respektíve 3,69; 7,72; 38,14 kgf/cm2. Teplo topenia 90,3 kJ/kg (21,5 cal/g); výparné teplo 288 kJ/kg (68,8 cal/g); Tepelná kapacita plynu pri konštantnom tlaku je 0,48 kJ/(kg K). Kritické konštanty chlóru: teplota 144°C, tlak 7,72 Mn/m2 (77,2 kgf/cm2), hustota 573 g/l, špecifický objem 1,745·10-3 l/g. Rozpustnosť (v g/l) chlóru pri parciálnom tlaku 0,1 Mn/m2 alebo 1 kgf/cm2 vo vode 14,8 (0 °C), 5,8 (30 °C), 2,8 (70 °C); v roztoku 300 g/l NaCl 1,42 (30 °C), 0,64 (70 °C). Pod 9,6 °C sa vo vodných roztokoch tvoria hydráty chlóru rôzneho zloženia Cl2.nH20 (kde n = 6-8); Sú to žlté kubické kryštály, ktoré sa so zvyšujúcou sa teplotou rozkladajú na Chlór a vodu. Chlór je vysoko rozpustný v TiCl 4, SiCl 4, SnCl 4 a niektorých organických rozpúšťadlách (najmä hexán C 6 H 14 a tetrachlórmetán CCl 4). Molekula chlóru je dvojatómová (Cl 2). Stupeň tepelnej disociácie Cl 2 + 243 kJ = 2Cl pri 1000 K je 2,07·10 -4 %, pri 2500 K 0,909 %.
Chemické vlastnosti chlóru. Externá elektronická konfigurácia atómu Cl 3s 2 Sp 5. V súlade s tým vykazuje chlór v zlúčeninách oxidačné stavy -1, +1, +3, +4, +5, +6 a +7. Kovalentný polomer atómu je 0,99 E, iónový polomer Cl je 1,82 E, elektrónová afinita atómu chlóru je 3,65 eV a ionizačná energia je 12,97 eV.
Chemicky je chlór veľmi aktívny, priamo sa spája s takmer všetkými kovmi (s niektorými len za prítomnosti vlhkosti alebo pri zahriatí) a s nekovmi (okrem uhlíka, dusíka, kyslíka, inertných plynov), pričom vytvára zodpovedajúce chloridy, reaguje s mnohých zlúčenín, nahrádza vodík v nasýtených uhľovodíkoch a spája nenasýtené zlúčeniny. Chlór vytláča bróm a jód z ich zlúčenín vodíkom a kovmi; Zo zlúčenín chlóru s týmito prvkami je nahradený fluórom. Alkalické kovy v prítomnosti stôp vlhkosti reagujú s chlórom vznietením, väčšina kovov reaguje so suchým chlórom iba pri zahriatí. Oceľ, ako aj niektoré kovy, sú odolné v atmosfére suchého chlóru pri nízkych teplotách, preto sa používajú na výrobu zariadení a skladovacích priestorov na suchý chlór. Fosfor sa vznieti v atmosfére chlóru za vzniku PCl 3 a pri ďalšej chlorácii - PCl 5; síra s chlórom pri zahriatí dáva S 2 Cl 2, SCl 2 a iné S n Cl m. Arzén, antimón, bizmut, stroncium, telúr intenzívne interagujú s chlórom. Zmes chlóru a vodíka horí bezfarebným alebo žltozeleným plameňom za vzniku chlorovodíka (ide o reťazovú reakciu).
Maximálna teplota vodíkovo-chlórového plameňa je 2200°C. Zmesi chlóru s vodíkom s obsahom 5,8 až 88,5 % H2 sú výbušné.
S kyslíkom tvorí chlór oxidy: Cl 2 O, ClO 2, Cl 2 O 6, Cl 2 O 7, Cl 2 O 8, ako aj chlórnany (soli kyseliny chlórnej), chloritany, chlorečnany a chloristany. Všetky kyslíkaté zlúčeniny chlóru tvoria výbušné zmesi s ľahko oxidovateľnými látkami. Oxidy chlóru sú slabo stabilné a môžu spontánne explodovať, chlórnany sa počas skladovania pomaly rozkladajú, chlorečnany a chloristany môžu explodovať pod vplyvom iniciátorov.
Chlór vo vode hydrolyzuje, pričom vznikajú kyseliny chlórne a chlorovodíkové: Cl 2 + H 2 O = HClO + HCl. Pri chlórovaní vodných roztokov alkálií za studena vznikajú chlórnany a chloridy: 2NaOH + Cl 2 = NaClO + NaCl + H 2 O a pri zahriatí vznikajú chlorečnany. Chloráciou suchého hydroxidu vápenatého vzniká bielidlo.
Keď amoniak reaguje s chlórom, vzniká chlorid dusitý. Pri chlórovaní organických zlúčenín chlór buď nahrádza vodík, alebo spája viacnásobné väzby, čím vznikajú rôzne organické zlúčeniny obsahujúce chlór.
Chlór tvorí interhalogénové zlúčeniny s inými halogénmi. Fluoridy ClF, ClF 3, ClF 3 sú veľmi reaktívne; napríklad v atmosfére ClF 3 sa sklená vata spontánne vznieti. Známe zlúčeniny chlóru s kyslíkom a fluórom sú oxyfluoridy chlóru: ClO 3 F, ClO 2 F 3, ClOF, ClOF 3 a chloristan fluóru FClO 4.
Získanie chlóru. Chlór sa začal priemyselne vyrábať v roku 1785 reakciou kyseliny chlorovodíkovej s oxidom mangánu (II) alebo pyroluzitom. V roku 1867 anglický chemik G. Deacon vyvinul spôsob výroby chlóru oxidáciou HCl vzdušným kyslíkom v prítomnosti katalyzátora. Od konca 19. a začiatku 20. storočia sa chlór vyrába elektrolýzou vodných roztokov chloridov alkalických kovov. Tieto metódy produkujú 90-95% chlóru na svete. Malé množstvá chlóru sa získavajú ako vedľajší produkt pri výrobe horčíka, vápnika, sodíka a lítia elektrolýzou roztavených chloridov. Používajú sa dva hlavné spôsoby elektrolýzy vodných roztokov NaCl: 1) v elektrolyzéroch s pevnou katódou a poréznou filtračnou membránou; 2) v elektrolyzéroch s ortuťovou katódou. Pri oboch metódach sa plynný chlór uvoľňuje na grafitovej alebo oxidovej titán-ruténiovej anóde. Podľa prvého spôsobu sa na katóde uvoľňuje vodík a vzniká roztok NaOH a NaCl, z ktorého sa následným spracovaním oddelí komerčný hydroxid sodný. Podľa druhého spôsobu vzniká na katóde sodíkový amalgám, pri rozklade čistou vodou v samostatnom prístroji sa získa roztok NaOH, vodík a čistá ortuť, ktorá sa opäť vyrába. Obe metódy poskytujú 1,125 t NaOH na 1 tonu chlóru.
Elektrolýza s diafragmou vyžaduje menšie kapitálové investície na organizáciu výroby chlóru a produkuje lacnejší NaOH. Metóda ortuťovej katódy produkuje veľmi čistý NaOH, ale strata ortuti znečisťuje životné prostredie.
Použitie chlóru. Jedným z dôležitých odvetví chemického priemyslu je chlórový priemysel. Hlavné množstvá chlóru sa spracúvajú v mieste jeho výroby na zlúčeniny obsahujúce chlór. Chlór sa skladuje a prepravuje v kvapalnej forme vo fľašiach, sudoch, železničných cisternách alebo v špeciálne vybavených nádobách. Priemyselné krajiny sa vyznačujú nasledovnou približnou spotrebou chlóru: na výrobu organických zlúčenín obsahujúcich chlór - 60-75%; anorganické zlúčeniny obsahujúce chlór, -10-20%; na bielenie buničiny a tkanín - 5-15%; pre sanitárne potreby a chlórovanie vody - 2-6% z celkovej produkcie.
Chlór sa používa aj na chlórovanie niektorých rúd na extrakciu titánu, nióbu, zirkónu a iných.
Chlór v tele. Chlór je jedným z biogénnych prvkov, stála zložka rastlinných a živočíšnych tkanív. Obsah chlóru v rastlinách (veľa chlóru v halofytoch) sa pohybuje od tisícin percent až po celé percentá, u zvierat - desatiny a stotiny percenta. Denná potreba chlóru (2-4 g) dospelého človeka je pokrytá potravinami. Chlór sa zvyčajne dodáva v nadbytku s potravinami vo forme chloridu sodného a chloridu draselného. Chlieb, mäso a mliečne výrobky sú obzvlášť bohaté na chlór. V organizme zvierat je chlór hlavnou osmoticky aktívnou látkou v krvnej plazme, lymfe, cerebrospinálnom moku a niektorých tkanivách. Hrá úlohu v metabolizme voda-soľ, podporuje zadržiavanie vody v tkanivách. Regulácia acidobázickej rovnováhy v tkanivách sa uskutočňuje spolu s ďalšími procesmi zmenou distribúcie chlóru medzi krvou a inými tkanivami. Chlór sa podieľa na energetickom metabolizme v rastlinách, pričom aktivuje oxidačnú fosforyláciu aj fotofosforyláciu. Chlór má pozitívny vplyv na absorpciu kyslíka koreňmi. Chlór je nevyhnutný na tvorbu kyslíka počas fotosyntézy izolovanými chloroplastmi. Väčšina živných médií na umelé pestovanie rastlín neobsahuje chlór. Je možné, že veľmi nízke koncentrácie chlóru stačia na vývoj rastlín.
Otrava chlórom je možná v chemickom, celulózo-papierenskom, textilnom, farmaceutickom priemysle a iných. Chlór dráždi sliznice očí a dýchacích ciest. Primárne zápalové zmeny sú zvyčajne sprevádzané sekundárnou infekciou. Akútna otrava sa vyvinie takmer okamžite. Pri vdýchnutí stredných a nízkych koncentrácií chlóru sa pozoruje tlak a bolesť na hrudníku, suchý kašeľ, zrýchlené dýchanie, bolesť očí, slzenie, zvýšená hladina leukocytov v krvi, telesná teplota atď.. Bronchopneumónia, toxický pľúcny edém , sú možné depresívne stavy, kŕče . V miernych prípadoch dochádza k zotaveniu do 3-7 dní. Ako dlhodobé následky sa pozorujú katary horných dýchacích ciest, recidivujúce bronchitídy, pneumoskleróza a iné; možná aktivácia pľúcnej tuberkulózy. Pri dlhšom vdychovaní malých koncentrácií chlóru sa pozorujú podobné, ale pomaly sa rozvíjajúce formy ochorenia. Prevencia otravy: utesnenie výrobných zariadení, zariadení, účinné vetranie, v prípade potreby použitie plynovej masky. Výroba chlóru, bielidiel a iných zlúčenín obsahujúcich chlór je klasifikovaná ako výroba s nebezpečnými pracovnými podmienkami.
1.4 Bróm
bróm(lat. Bromum), Br, chemický prvok skupiny VII periodického systému Mendelejeva, patrí medzi halogény; atómové číslo 35, atómová hmotnosť 79,904; červenohnedá kvapalina so silným nepríjemným zápachom. Bróm objavil v roku 1826 francúzsky chemik A. J. Balard pri štúdiu soľaniek stredomorských soľných polí; pomenované z gréčtiny. bromos - smrad. Prírodný bróm pozostáva z 2 stabilných izotopov 79Br (50,54 %) a 81Br (49,46 %). Z umelo získaných rádioaktívnych izotopov je najzaujímavejší Bróm 80 Br, na príklade ktorého I. V. Kurčatov objavil fenomén izomérie atómových jadier.
Distribúcia brómu v prírode. Obsah brómu v zemskej kôre (1,6·10 -4 % hm.) sa odhaduje na 10 15 -10 16 ton Bróm sa nachádza väčšinou v rozptýlenom stave vo vyvrelých horninách, ako aj v rozšírených halogenidoch. Bróm je stálym spoločníkom chlóru. Bromidové soli (NaBr, KBr, MgBr 2) sa nachádzajú v ložiskách chloridových solí (v kuchynskej soli do 0,03 % Br, v draselných soliach - sylvit a karnallit - do 0,3 % Br), ako aj v morskej vode (0,065 % Br), soľanky zo soľných jazier (do 0,2 % Br) a podzemné soľanky bežne spojené s ložiskami soli a ropy (do 0,1 % Br). Vďaka svojej dobrej rozpustnosti vo vode sa bromidové soli hromadia vo zvyškových soľných roztokoch morských a jazerných vodných útvarov. Bróm migruje vo forme ľahko rozpustných zlúčenín, veľmi zriedkavo vytvára pevné minerálne formy reprezentované brómyritom AgBr, embolitom Ag (Cl, Br) a jodembolitom Ag (Cl, Br, I). K tvorbe minerálov dochádza v oxidačných zónach ložísk sulfidického striebra, ktoré vznikajú v suchých púštnych oblastiach.
Fyzikálne vlastnosti brómu. Pri teplote -7,2 °C tekutý bróm tuhne a mení sa na červeno-hnedé ihličkovité kryštály so slabým kovovým leskom. Pary brómu sú žltohnedej farby, bod varu 58,78°C. Hustota kvapalného brómu (pri 20 °C) je 3,1 g/cm3. Bróm je obmedzene rozpustný vo vode, ale lepšie ako iné halogény (3,58 g brómu v 100 g H20 pri 20 °C). Pod 5,84°C sa z vody vyzrážajú granátovočervené kryštály Br 2 8H 2 O. Bróm je obzvlášť rozpustný v mnohých organických rozpúšťadlách, ktoré sa používajú na jeho extrakciu z vodných roztokov. Bróm v pevnom, kvapalnom a plynnom skupenstve pozostáva z 2-atómových molekúl. Zreteľná disociácia na atómy začína pri teplote okolo 800 °C; disociácia sa pozoruje aj pod vplyvom svetla.
Chemické vlastnosti brómu. Konfigurácia vonkajších elektrónov atómu brómu je 4s24p5. Valencia brómu v zlúčeninách je premenlivá, oxidačný stav je -1 (v bromidoch, napr. KBr), +1 (v brómnanoch NaBrO), +3 (v bromitoch NaBrO 2), +5 (v bromičnanoch KBrOz ) a +7 (v perbromátoch, NaBr04). Chemicky je bróm veľmi aktívny a zaujíma miesto v reaktivite medzi chlórom a jódom. Interakcia brómu so sírou, selénom, telúrom, fosforom, arzénom a antimónom je sprevádzaná silným zahrievaním, niekedy dokonca výskytom plameňa. Bróm tiež prudko reaguje s niektorými kovmi, ako je draslík a hliník. Mnohé kovy však reagujú s bezvodým brómom s ťažkosťami v dôsledku tvorby ochranného filmu bromidu, ktorý je nerozpustný v bróme, na ich povrchu. Z kovov sú najodolnejšie voči pôsobeniu Brómu aj pri zvýšených teplotách a za prítomnosti vlhkosti striebro, olovo, platina a tantal (zlato na rozdiel od platiny energicky reaguje s brómom). Bróm sa priamo nespája s kyslíkom, dusíkom a uhlíkom, a to ani pri zvýšených teplotách. Zlúčeniny brómu s týmito prvkami sa získavajú nepriamo. Ide o mimoriadne krehké oxidy Br 2 O, Br O 2 a Br 3 O 8 (ten sa získava napr. pôsobením ozónu na bróm pri 80°C). Bróm priamo reaguje s halogénmi za vzniku BrF 3, BrF 5, BrCl, IBr a ďalších.
Bróm je silné oxidačné činidlo. Oxiduje teda siričitany a tiosírany vo vodných roztokoch na sírany, dusitany na dusičnany, amoniak na voľný dusík (3Br 2 + 8NH 3 = N 2 + NH 4 Br). Bróm vytláča jód zo svojich zlúčenín, ale sám je nahradený chlórom a fluórom. Voľný bróm sa z vodných roztokov bromidov uvoľňuje aj vplyvom silných oxidačných činidiel (KMnO 4, K 2 Cr 2 O 7) v kyslom prostredí. Keď sa bróm rozpustí vo vode, čiastočne s ním reaguje (Br 2 + H 2 O = HBr + HBrO) za vzniku kyseliny bromovodíkovej HBr a nestabilnej kyseliny bromnej HBrO. Roztok brómu vo vode sa nazýva brómová voda. Keď sa bróm rozpúšťa v alkalických roztokoch za studena, tvorí sa bromid a bromnan (2NaOH + Br 2 = NaBr + NaBrO + H 2 O) a pri zvýšených teplotách (asi 100 °C) - bromid a bromičnan (6NaOH + 3Br 2 = 5NaBr + NaBr03 + 3H20). Z reakcií brómu s organickými zlúčeninami sú najtypickejšie adícia na dvojitej väzbe C=C, ako aj substitúcia vodíka (zvyčajne pôsobením katalyzátorov alebo svetla).
Získanie brómu. Východiskové suroviny na výrobu brómu sú morská voda, jazerné a podzemné soľné roztoky a draselné luhy na výrobu brómu vo forme bromidového iónu Br - (od 65 g/m 3 v morskej vode po 3-4 kg/m 3 a vyššie pri výrobe draselných lúhov). Bróm sa izoluje pomocou chlóru (2Br - + Cl 2 = Br 2 + 2Cl -) a oddestiluje sa z roztoku vodnou parou alebo vzduchom. Parné stripovanie sa vykonáva v stĺpoch vyrobených zo žuly, keramiky alebo iného materiálu odolného voči brómu. Zhora sa do kolóny privádza zohriata soľanka a zdola sa privádza chlór a vodná para. Pary brómu opúšťajúce kolónu kondenzujú v keramických chladničkách. Ďalej sa bróm oddelí od vody a destiláciou sa čistí od chlórových nečistôt. Stripovanie vzduchom umožňuje na získanie brómu použiť soľanky s nízkym obsahom brómu, extrahovať z nich bróm parou je nerentabilné v dôsledku vysokej spotreby pary. Z výslednej zmesi bróm-vzduch sa pomocou chemických absorbentov odstraňuje bróm. Na tento účel sa používajú roztoky bromidu železitého (2FeBr 2 + Br 2 = 2FeBr 3), ktorý sa zase získava redukciou FeBr 3 železnými pilinami, ako aj roztoky hydroxidov alebo uhličitanov sodných alebo plynný oxid siričitý reagujúci s Bróm v prítomnosti vodnej pary s tvorbou kyseliny bromovodíkovej a sírovej (Br 2 + SO 2 + 2H 2 O = 2HBr + H 2 SO 4). Z výsledných medziproduktov sa izoluje bróm pôsobením chlóru (z FeBr3 a HBr) alebo kyseliny (5NaBr + NaBr03 + 3H2S04 = 3Br2 + 3Na2S04 + 3H20). V prípade potreby sa medziprodukty spracovávajú na bromidové zlúčeniny bez uvoľnenia elementárneho brómu.
Vdychovanie pár brómu, keď je ich obsah vo vzduchu 1 mg/m3 alebo viac, spôsobuje kašeľ, nádchu, krvácanie z nosa, závraty, bolesti hlavy; pri vyšších koncentráciách - dusenie, bronchitída, niekedy smrť. Maximálna prípustná koncentrácia pár brómu vo vzduchu je 2 mg/m3. Tekutý bróm pôsobí na pokožku a spôsobuje zle sa hojace popáleniny. Práca s brómom by sa mala vykonávať v digestoroch. V prípade otravy parami brómu sa odporúča inhalovať amoniak, na tento účel použiť jeho silne zriedený roztok vo vode alebo etylalkohole. Bolesť hrdla spôsobená vdychovaním pár brómu sa zmierňuje požitím horúceho mlieka. Bróm, ktorý sa dostane na pokožku, sa zmyje veľkým množstvom vody alebo sa sfúkne silným prúdom vzduchu. Popálené miesta sa premasťujú lanolínom.
Aplikácia brómu. Bróm sa používa pomerne široko. Je východiskovým produktom na výrobu množstva bromidových solí a organických derivátov. Veľké množstvá brómu sa používajú na výrobu etylbromidu a dibrómetánu - zložky etylovej kvapaliny pridávanej do benzínu na zvýšenie ich odolnosti voči detonácii. Zlúčeniny brómu sa používajú vo fotografii, pri výrobe množstva farbív, ako insekticídy sa používajú metylbromid a niektoré ďalšie zlúčeniny brómu. Niektoré organické zlúčeniny brómu slúžia ako účinné hasiace prostriedky. Bróm a brómová voda sa používajú v chemických rozboroch na stanovenie mnohých látok. V medicíne sa používajú bromidy sodné, draselné, amónne, ako aj organické zlúčeniny brómu, ktoré sa používajú pri neurózach, hystérii, zvýšenej podráždenosti, nespavosti, hypertenzii, epilepsii a chorei.
Bróm v tele. Bróm je stálou zložkou živočíšnych a rastlinných tkanív. Suchozemské rastliny obsahujú v surovine priemerne 7·10 -4% brómu, živočíchy ~1·10 -4%. Bróm sa nachádza v rôznych sekrétoch (slzy, sliny, pot, mlieko, žlč). V krvi zdravého človeka sa obsah brómu pohybuje od 0,11 do 2,00 mg%. Pomocou rádioaktívneho brómu (82 Br) bola stanovená jeho selektívna absorpcia štítnou žľazou, dreňom obličiek a hypofýzou. Bromidy zavádzané do tela zvierat a ľudí zvyšujú koncentráciu inhibičných procesov v mozgovej kôre a pomáhajú normalizovať stav nervovej sústavy, ktorá trpí prepätím inhibičného procesu. Bróm sa zároveň zdržiavaním v štítnej žľaze dostáva do konkurenčného vzťahu s jódom, čo ovplyvňuje činnosť žľazy a v súvislosti s tým aj stav metabolizmu.
1.5 jód
jód(lat. Iodum), I, chemický prvok skupiny VII periodického systému Mendelejeva, patrí medzi halogény (v literatúre sa nachádza aj zastaraný názov Jód a symbol J); atómové číslo 53, atómová hmotnosť 126,9045; kryštály čierno-sivej farby s kovovým leskom. Prírodný jód pozostáva z jedného stabilného izotopu s hmotnostným číslom 127. Jód objavil v roku 1811 francúzsky chemik B. Courtois. Zahrievaním materského nálevu z popola z morských rias s koncentrovanou kyselinou sírovou pozoroval uvoľňovanie fialovej pary (odtiaľ názov Jód - z gréckeho jodes, ioides - fialovej farby, fialovej), ktorá kondenzovala do tmavej lesklej doštičkovitej kryštály. V rokoch 1813-1814 francúzsky chemik J. L. Gay-Lussac a anglický chemik G. Davy dokázali elementárnu povahu jódu.
Distribúcia jódu v prírode. Priemerný obsah jódu v zemskej kôre je 4,10 -5 % hmotnosti. Zlúčeniny jódu sú rozptýlené v plášti a magmatách a v horninách z nich vytvorených (žuly, bazalty a iné); hlboké minerály jódu nie sú známe. História jódu v zemskej kôre úzko súvisí so živou hmotou a biogénnou migráciou. V biosfére pozorujú procesy jej koncentrácie najmä morské organizmy (riasy, huby a iné). Je známe, že v biosfére sa tvorí osem supergénnych jódových minerálov, ale sú veľmi zriedkavé. Hlavným rezervoárom jódu pre biosféru je Svetový oceán (1 liter obsahuje v priemere 5·10 -5 g jódu). Z oceánu sa zlúčeniny jódu rozpustené v kvapkách morskej vody dostávajú do atmosféry a vetrom sú prenášané na kontinenty. (Oblasti vzdialené od oceánu alebo oplotené pred morskými vetrami horami sú ochudobnené o jód.) Jód sa ľahko adsorbuje organickou hmotou v pôde a morskom bahne. Keď sa tieto kaly zhutnia a vytvoria sa sedimentárne horniny, dôjde k desorpcii a niektoré zlúčeniny jódu prejdú do podzemnej vody. Takto vznikajú jódovo-brómové vody používané na ťažbu jódu, charakteristické najmä pre oblasti ropných polí (niekde 1 liter týchto vôd obsahuje cez 100 mg jódu).
Fyzikálne vlastnosti jódu. Hustota jódu je 4,94 g/cm 3, teplota topenia 113,5°C, teplota varu 184,35°C. Molekula kvapalného a plynného jódu pozostáva z dvoch atómov (I 2). Pozorovateľná disociácia I 2 = 2I sa pozoruje nad 700 °C, ako aj pod vplyvom svetla. Už pri bežných teplotách sa jód vyparuje a vytvára ostro zapáchajúcu fialovú paru. Pri miernom zahriatí jód sublimuje a usadzuje sa vo forme lesklých tenkých dosiek; tento proces slúži na čistenie jódu v laboratóriách a priemysle. Jód je slabo rozpustný vo vode (0,33 g/l pri 25 °C), dobre rozpustný v sírouhlíku a organických rozpúšťadlách (benzén, alkohol a iné), ako aj vo vodných roztokoch jodidov.
Chemické vlastnosti jódu. Konfigurácia vonkajších elektrónov atómu jódu je 5s 2 5p 5. V súlade s tým má jód premennú mocnosť (oxidačný stav) v zlúčeninách: -1 (v HI, KI), +1 (v HIO, KIO), +3 (v ICl 3), +5 (v HIO 3, KIO 3) a +7 (v HIO 4, KIO 4). Chemicky je jód dosť aktívny, aj keď v menšej miere ako chlór a bróm. Jód pri miernom zahriatí prudko reaguje s kovmi za tvorby jodidov (Hg + I 2 = HgI 2). Jód reaguje s vodíkom iba pri zahriatí a nie úplne, pričom vzniká jodovodík. Jód sa nespája priamo s uhlíkom, dusíkom alebo kyslíkom. Elementárny jód je oxidačné činidlo, menej účinné ako chlór a bróm. Sírovodík H 2 S, tiosíran sodný Na 2 S 2 O 3 a ďalšie redukčné činidlá ho redukujú na I - (I 2 + H 2 S = S + 2HI). Chlór a iné silné oxidačné činidlá vo vodných roztokoch ho premieňajú na IO 3 - (5Cl 2 + I 2 + 6H 2 O = 2HIO 3 H + 10HCl). Po rozpustení vo vode s ním jód čiastočne reaguje (I 2 + H 2 O = HI + HIO); v horúcich vodných roztokoch alkálií vzniká jodid a jodičnan (3I 2 + 6NaOH = 5NaI + NaIO 3 + 3H 2 O). Keď sa jód adsorbuje na škrob, zmení ho na tmavomodrý; používa sa v jodometrii a kvalitatívnej analýze na detekciu jódu.
Výpary jódu sú jedovaté a dráždia sliznice. Jód má kauterizačný a dezinfekčný účinok na pokožku. Jódové škvrny sa umyjú roztokmi sódy alebo tiosíranu sodného.
Získanie jódu. Surovinou na priemyselnú výrobu jódu je voda z ropných vrtov; morské riasy, ako aj materské roztoky čílskeho (sodného) dusičnanu s obsahom do 0,4 % Jódu vo forme jodičnanu sodného. Na extrakciu jódu z ropných vôd (zvyčajne s obsahom 20-40 mg/l jódu vo forme jodidov) sa tieto najskôr upravia chlórom (2 NaI + Cl 2 = 2NaCl + I 2) alebo kyselinou dusitou (2NaI + 2NaNO 2 + 2H2S04 = 2Na2S04 + 2NO + I2 + 2H20). Uvoľnený jód je buď adsorbovaný aktívnym uhlím alebo vyfukovaný vzduchom. Jód adsorbovaný uhlím sa spracuje žieravinou alebo siričitanom sodným (I2 + Na2S03 + H20 = Na2S04 + 2HI). Voľný jód sa izoluje z reakčných produktov pôsobením chlóru alebo kyseliny sírovej a oxidačného činidla, napríklad dvojchrómanu draselného (K 2 Cr 2 O 7 + 7H 2 SO 4 + 6NaI = K 2 SO 4 + 3Na 2 SO 4 + Cr2(S04)S + 3I2). Pri vyfukovaní vzduchom sa jód absorbuje zmesou oxidu sírového (IV) s vodnou parou (2H 2 O + SO 2 + I 2 = H 2 SO 4 + 2HI) a potom sa jód nahradí chlórom (2HI + Cl 2 = 2 HCl + I2). Surový kryštalický jód sa čistí sublimáciou.
Aplikácia jódu. Jód a jeho zlúčeniny sa používajú najmä v medicíne a analytickej chémii, ako aj v organickej syntéze a fotografii.
Jód v tele. Jód je mikroelement nevyhnutný pre zvieratá a ľudí. V pôdach a rastlinách tajgy-lesných nečernozemných, suchých stepných, púštnych a horských biogeochemických zón je jód obsiahnutý v nedostatočnom množstve alebo nie je v rovnováhe s niektorými ďalšími mikroelementmi (Co, Mn, Cu); To súvisí s rozšírením endemickej strumy v týchto oblastiach. Priemerný obsah jódu v pôde je asi 3·10 -4%, v rastlinách asi 2·10 -5%. V povrchových pitných vodách je málo jódu (od 10 -7 do 10 -9%). V prímorských oblastiach môže množstvo jódu v 1 m 3 vzduchu dosiahnuť 50 mcg, v kontinentálnych a horských oblastiach je to 1 alebo dokonca 0,2 mcg.
Absorpcia jódu rastlinami závisí od obsahu jeho zlúčenín v pôde a od druhu rastliny. Niektoré organizmy (tzv. koncentrátory jódu), napríklad morské riasy - fucus, chaluha, phyllophora, akumulujú až 1% jódu, niektoré huby - až 8,5% (v kostnej látke spongin). Na jeho priemyselnú výrobu sa používajú riasy, ktoré koncentrujú jód. Jód vstupuje do tela zvieraťa s jedlom, vodou a vzduchom. Hlavným zdrojom jódu sú rastlinné produkty a krmivo. K absorpcii jódu dochádza v predných častiach tenkého čreva. V ľudskom tele sa akumuluje 20 až 50 mg jódu, z toho asi 10 až 25 mg vo svaloch a 6 až 15 mg v štítnej žľaze. Pomocou rádioaktívneho jódu (131 I a 125 I) sa ukázalo, že v štítnej žľaze sa jód hromadí v mitochondriách epitelových buniek a je súčasťou v nich vytvorených dijód- a monojódtyrozínov, ktoré kondenzujú na hormón tetrajódtyronín (tyroxín). Jód sa z tela vylučuje najmä obličkami (až 70 – 80 %), mliečnymi, slinnými a potnými žľazami, čiastočne aj žlčou.
V rôznych biogeochemických provinciách sa obsah jódu v dennej strave líši (pre ľudí od 20 do 240 mcg, pre ovce od 20 do 400 mcg). Potreba jódu zvieraťa závisí od jeho fyziologického stavu, ročného obdobia, teploty a prispôsobenia organizmu obsahu jódu v prostredí. Denná potreba jódu u ľudí a zvierat je asi 3 mcg na 1 kg telesnej hmotnosti (zvyšuje sa počas tehotenstva, zvýšeného rastu a ochladzovania). Zavedenie jódu do tela zvyšuje bazálny metabolizmus, podporuje oxidačné procesy, tonizuje svaly a stimuluje sexuálne funkcie.
Pre väčší či menší deficit Jódu v potrave a vode sa používa jodizácia kuchynskej soli, zvyčajne s obsahom 10-25 g jodidu draselného na 1 tonu soli. Používanie hnojív obsahujúcich jód môže zdvojnásobiť alebo strojnásobiť jeho obsah v plodinách.
Jód v medicíne. Prípravky s obsahom jódu majú antibakteriálne a protiplesňové vlastnosti, pôsobia aj protizápalovo a rušivo; Zvonka sa používajú na dezinfekciu rán a prípravu operačného poľa. Pri perorálnom užívaní jódové prípravky ovplyvňujú metabolizmus a zlepšujú funkciu štítnej žľazy. Malé dávky jódu (mikrojód) inhibujú funkciu štítnej žľazy a ovplyvňujú tvorbu hormónu stimulujúceho štítnu žľazu v prednej hypofýze. Keďže jód ovplyvňuje metabolizmus bielkovín a tukov (lipidov), našiel uplatnenie pri liečbe aterosklerózy, pretože znižuje cholesterol v krvi; tiež zvyšuje fibrinolytickú aktivitu krvi. Na diagnostické účely sa používajú látky nepriepustné pre žiarenie obsahujúce jód.
Pri dlhodobom užívaní jódových prípravkov a pri zvýšenej citlivosti na ne sa môže objaviť jodizmus - nádcha, žihľavka, Quinckeho edém, slinenie a slzenie, aknózna vyrážka (jododerma) atď. Jódové prípravky sa nemajú užívať pri pľúcnej tuberkulóze , tehotenstvo, ochorenie obličiek, chronická pyodermia, hemoragická diatéza, žihľavka.
Jód je rádioaktívny. Umelo rádioaktívne izotopy jódu - 125 I, 131 I, 132 I a ďalšie sú široko používané v biológii a najmä v medicíne na určenie funkčného stavu štítnej žľazy a liečbu množstva jej ochorení. Použitie rádioaktívneho jódu v diagnostike je spojené so schopnosťou jódu selektívne sa hromadiť v štítnej žľaze; použitie na liečebné účely je založené na schopnosti beta-žiarenia rádioizotopov jódu ničiť sekrečné bunky žľazy. Keď je prostredie kontaminované produktmi jadrového štiepenia, rádioaktívne izotopy jódu rýchlo vstupujú do biologického cyklu, v konečnom dôsledku končia v mlieku a následne v ľudskom tele. Nebezpečný je najmä ich prienik do organizmu detí, ktorých štítna žľaza je 10-krát menšia ako u dospelých a má aj väčšiu rádiosenzitivitu. Na zníženie ukladania rádioaktívnych izotopov jódu v štítnej žľaze sa odporúča používať stabilné jódové prípravky (100-200 mg na dávku). Rádioaktívny jód sa rýchlo a úplne absorbuje z gastrointestinálneho traktu a selektívne sa ukladá v štítnej žľaze. Jeho absorpcia závisí od funkčného stavu žľazy. Pomerne vysoké koncentrácie rádioizotopov jódu sa nachádzajú aj v slinných a mliečnych žľazách a na sliznici tráviaceho traktu. Rádioaktívny jód neabsorbovaný štítnou žľazou sa takmer úplne a pomerne rýchlo vylučuje močom.
Podobné dokumenty
Štúdium pojmu a základných vlastností halogénov - chemických prvkov (fluór, chlór, bróm, jód a astatín), tvoriacich hlavnú podskupinu skupiny VII periodickej tabuľky D.I. Mendelejev. Pozitívne a negatívne účinky halogénov na ľudský organizmus.
prezentácia, pridané 20.10.2011
História objavov a miesto v periodickej tabuľke chemických prvkov D.I. Mendelejevove halogény: fluór, chlór, bróm, jód a astatín. Chemické a fyzikálne vlastnosti prvkov, ich použitie. Prevalencia prvkov a tvorba jednoduchých látok.
prezentácia, pridané 13.03.2014
Chemické prvky súvisiace s halogénmi: fluór, chlór, bróm, jód a astatín. Chemická charakteristika, atómové čísla prvkov, ich fyzikálne vlastnosti, ionizačná energia a elektronegativita. Oxidačné stavy halogénov, disociačná energia.
prezentácia, pridané 16.12.2013
Pojem a praktický význam halogénov, ich fyzikálne a chemické vlastnosti, charakteristické znaky. Charakteristika a spôsoby výroby halogénov: jód, bróm, chlór, fluór, astatín. Reakcie charakteristické pre tieto halogény, oblasti ich použitia.
prezentácia, pridané 3.11.2011
Všeobecná charakteristika chemických prvkov IV. skupiny periodickej tabuľky, ich výskyt v prírode a zlúčeniny s inými nekovmi. Príprava germánia, cínu a olova. Fyzikálno-chemické vlastnosti kovov podskupiny titánu. Oblasti použitia zirkónu.
prezentácia, pridané 23.04.2014
Halogény sú chemické prvky patriace do hlavnej podskupiny skupiny VII periodického systému Mendelejeva. Medzi halogény patrí fluór, chlór, bróm, jód a astatín. Všetky halogény sú energetické oxidačné činidlá, a preto sa v prírode vyskytujú iba vo forme zlúčenín.
abstrakt, pridaný 20.03.2009
Chlór je 17. prvok periodickej tabuľky chemických prvkov tretej periódy s atómovým číslom 17. Chemicky aktívny nekov, súčasť halogénovej skupiny. Fyzikálne vlastnosti chlóru, interakcia s kovmi a nekovmi, oxidačné reakcie.
prezentácia, pridané 26.12.2011
Vlastnosti prvkov dusíkatej podskupiny, štruktúra a charakteristika atómov. Zvýšenie kovových vlastností pri pohybe prvkov zhora nadol v periodickej tabuľke. Rozdelenie dusíka, fosforu, arzénu, antimónu a bizmutu v prírode, ich využitie.
abstrakt, pridaný 15.06.2009
Fyzikálne a chemické vlastnosti halogénov, ich postavenie v Mendelejevovej periodickej tabuľke prvkov. Hlavné zdroje a biologický význam chlóru, brómu, jódu, fluóru. Hľadanie halogénov v prírode, ich výroba a priemyselné využitie.
prezentácia, pridané 12.01.2014
Všeobecné vlastnosti kovov. Definícia, štruktúra. Všeobecné fyzikálne vlastnosti. Spôsoby získavania kovov. Chemické vlastnosti kovov. Kovové zliatiny. Charakteristika prvkov hlavných podskupín. Charakteristika prechodných kovov.
Prvky zahrnuté v skupine VII periodickej tabuľky sú rozdelené do dvoch podskupín: hlavná - halogénová podskupina - a sekundárna - mangánová podskupina. Do tejto skupiny patrí aj vodík, hoci jeho atóm má jeden elektrón na vonkajšej valenčnej úrovni a mal by byť zaradený do skupiny I. Vodík má však veľmi málo spoločného s prvkami hlavnej podskupiny – alkalickými kovmi, ako aj s prvkami sekundárnej podskupiny – meďou, striebrom a zlatom. Zároveň, podobne ako halogény, pridáva elektrón v reakciách s aktívnymi kovmi a vytvára hydridy, ktoré majú určitú podobnosť s halogenidmi.
Podskupina halogénov zahŕňa fluór, chlór, bróm, jód a astatín. Prvé štyri prvky sa nachádzajú v prírode, posledný sa získava umelo, a preto bol skúmaný oveľa menej ako ostatné halogény. Slovo halogén znamená soľotvorný. Prvky podskupiny dostali tento názov vďaka ľahkosti, s akou reagujú s mnohými kovmi za tvorby solí.Všetky halogény majú štruktúru vonkajšieho elektrónového obalu s 2 p 5. Preto ľahko prijímajú elektrón a vytvárajú stabilný elektrónový obal vzácneho plynu (s 2 p 6). Fluór má najmenší atómový polomer v podskupine; pre zvyšok sa zvyšuje v sérii F< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов к электрону. Галогены - очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром - иод из иодидов. Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше одного неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода К подгруппе марганца принадлежат марганец, технеций и рений. В отличии от галогенов элементы подгруппы марганца имеют на внешнем электронном уровне всего два электрона и поэтому не проявляют способности присоединять электроны, образуя отрицательно заряженные ионы.Марганец распространен в природе и широко используется в промышленности.Технеций радиоактивен, в природе не встречаемся, а получен искусственно (впервые - Э. Сегре и К.Перрье, 1937}. Этот элемент образуется вследствие радиоактивного распада урана. Рений относится к числу рассеянных элементов. Он не образует самостоятельных минералов, а встречается в качестве спутника некоторых минералов, особенно молибденовых. Он был открыт В. и И. Ноддак в 1925 г. Сплавы, имеющие небольшие добавки рения, обладают повышенной устойчивостью против коррозии. Добавка рения к и ее сплавам увеличивает их механическую прочность. Это свойство рения позволяет применять его вместо благородного металла иридия. Платино-платинорениевые термопары работают лучше платино-платиноиридиевых, но их нельзя использовать при очень высоких температурах, так как образуется летучее соединение Re 2 O 7 .
Charakteristickým znakom nekovov je väčší (v porovnaní s kovmi) počet elektrónov na vonkajšej energetickej úrovni ich atómov. To určuje ich väčšiu schopnosť pripájať ďalšie elektróny a prejavovať vyššiu oxidačnú aktivitu ako kovy. Obzvlášť silné oxidačné vlastnosti, t.j. schopnosť pridávať elektróny, vykazujú nekovy nachádzajúce sa v 2. a 3. perióde skupín VI-VII. Ak porovnáme usporiadanie elektrónov v orbitáloch v atómoch fluóru, chlóru a iných halogénov, môžeme posúdiť ich charakteristické vlastnosti. Atóm fluóru nemá žiadne voľné orbitály. Preto môžu atómy fluóru vykazovať len valenciu I a oxidačný stupeň 1. Najsilnejším oxidačným činidlom je fluór. V atómoch iných halogénov, napríklad v atóme chlóru, sú na rovnakej energetickej úrovni voľné d-orbitály. Vďaka tomu môže dôjsť k párovaniu elektrónov tromi rôznymi spôsobmi. V prvom prípade môže chlór vykazovať oxidačný stav +3 a vytvárať kyselinu chlórnu HClO2, čo zodpovedá soliam - chloritanom, napríklad chloritanu draselnému KClO2. V druhom prípade môže chlór vytvárať zlúčeniny, v ktorých je oxidačný stav chlóru +5. Medzi takéto zlúčeniny patrí kyselina chlórna HClO3 a jej soli - chlorečnany, napríklad chlorečnan draselný KClO3 (Bertholletova soľ). V treťom prípade má chlór oxidačný stav +7, napríklad v kyseline chloristej HClO4 a jej soliach, chloristanoch (v chloristane draselnom KClO4).
Jednotlivé analytické reakcie iónov Mn 2+
1.5.5. Oxidácia bizmutitanom sodným NaBiO 3 prebieha podľa rovnice:
2Mn(N03)2 + 5NaBi03 + 16HN03 = 2HMn04 + 5Bi(N03)3 + 5NaN03 + 7H20.
Reakcia nastáva v chlade. Vykonanie reakcie: pridajte 3-4 kvapky 6 M roztoku HNO 3 a 5-6 kvapiek H 2 O k 1-2 kvapkám roztoku mangánovej soli, potom sa špachtľou pridá trochu prášku NaBiO 3 . Po premiešaní obsahu skúmavky ju nechajte 1-2 minúty odstáť, potom centrifugujte, aby sa oddelil prebytočný bizmutitan sodný. V prítomnosti Mn 2+ sa roztok sfarbí do fialova v dôsledku tvorby kyseliny mangánovej, ktorá je jedným z najsilnejších oxidačných činidiel.
1.5.6. Oxidácia PbO 2 oxidom olovnatým v prostredí kyseliny dusičnej pri zahrievaní:
2Mn(N03)2 + 5Pb02 + 6HN03 -> 2HMn04 + 5Pb(N03)2 + 2H20.
Vykonanie reakcie: Vezmite trochu prášku PbO 2 a vložte ho do skúmavky, pridajte tam 4-5 kvapiek 6 M HNO 3 a zahrievajte za miešania. Vzhľad fialovej farby indikuje prítomnosť Mn2+.
1.5.7. V analýze sú dôležité reakcie Mn 2+ s uhličitanmi alkalických kovov, hydrogenfosforečnan sodný, oxidačné reakcie s persíranom amónnym, oxidácia benzidínu zlúčeninami Mn 4+, redukcia AgCl na kovové striebro iónmi Mn 2+.
88. Prvky skupiny VIII B. Typické vlastnosti najdôležitejších zlúčenín. Biologická úloha. Analytické reakcie na ióny Fe 3+ a Fe 2+.
Podskupina železa- chemické prvky 8. skupiny periodickej tabuľky chemických prvkov (podľa zastaranej klasifikácie - prvky sekundárnej podskupiny VIII. skupiny). Skupina zahŕňa železo Fe, ruténium Ru a osmium Os. Na základe elektrónovej konfigurácie atómu patrí do rovnakej skupiny aj umelo syntetizovaný prvok Hassiy Hs, ktorý bol objavený v roku 1984 vo Výskumnom centre ťažkých iónov (Nemecko). Gesellschaft für Schwerionenforschung, GSI), Darmstadt, Nemecko v dôsledku bombardovania oloveného (208 Pb) terča lúčom iónov železa-58 z urýchľovača UNILAC. Výsledkom experimentu bolo syntetizovaných 3 265 jadier Hs, ktoré boli spoľahlivo identifikované parametrami α-rozpadového reťazca. Súčasne a nezávisle bola rovnaká reakcia študovaná na SÚJV (Dubna, Rusko), kde sa na základe pozorovania 3 udalostí α-rozpadu jadra 253 Es tiež dospelo k záveru, že v tejto reakcii jadro 265 Hs, subjekt na α-rozpad, bol syntetizovaný. Všetky prvky skupiny 8 obsahujú vo svojich valenčných obaloch 8 elektrónov. Dva prvky skupiny - ruténium a osmium - patria do rodiny platinových kovov. Rovnako ako v iných skupinách, členovia skupiny 8 prvkov vykazujú vzory elektronickej konfigurácie, najmä vo svojich vonkajších obaloch, aj keď, napodiv, ruténium tento trend nesleduje. Prvky tejto skupiny však vykazujú podobnosti aj vo fyzikálnych vlastnostiach a chemickom správaní: Železo sa v prírode vyskytuje len zriedkavo v čistej forme, najčastejšie sa nachádza v železo-niklových meteoritoch. Prevalencia železa v zemskej kôre je 4,65 % (4. miesto po kyslíku, kremíku a hliníku). Tiež sa verí, že železo tvorí väčšinu zemského jadra.
Ruténium je jediný platinový kov, ktorý sa nachádza v živých organizmoch. (Podľa niektorých zdrojov - aj platina). Koncentrovaný hlavne vo svalovom tkanive. Vyšší oxid ruténia je extrémne toxický a ako silné oxidačné činidlo môže spôsobiť horenie horľavých látok.
Analytické reakcie
Hexakyanoželezitan draselný (III) K3 s katiónom Fe2+ tvorí modrú zrazeninu „Turnboole blue“:
3FeSO4 + 2K3 → Fe32↓+ 3K2S04,
3Fe 2+ + 2Fe(CN) 6 3– → Fe 3 2 ↓.
Zrazenina sa nerozpúšťa v kyselinách, ale rozkladá sa zásadami za vzniku Fe(OH) 2. Ak je činidla prebytok, zrazenina sa zmení na zelenú. Reakciu rušia ióny Fe 3+, ktoré vo vysokých koncentráciách dávajú reagentu hnedé sfarbenie roztoku a ióny Mn 2+ a Bi 3+, ktoré dávajú reagentu slabo sfarbené zrazeniny, rozpustné v kyselinách. Vykonávanie reakcií. Do skúmavky dajte 1–2 kvapky roztoku FeSO 4 a pridajte 1 kvapku činidla. Vzniknutú zrazeninu rozdeľte na dve časti, do prvej pridajte 1-2 kvapky 2M roztoku HC1 a do druhej 1-2 kvapky 2M alkalického roztoku. Reakčné podmienky sú so zriedenými roztokmi v kyslom prostredí, pH = 3.
1.5.2.> Oxidácia Fe 2+ na Fe 3+. Ión Fe2+ je pomerne silné redukčné činidlo a môže sa oxidovať pôsobením mnohých oxidačných činidiel, napríklad H202, KMnO4, K2Cr207 v kyslom prostredí atď.
2Fe2+ + 4OH – + H202 → 2Fe(OH)3↓.
Pri vykonávaní systematickej analýzy by sa Fe2+ malo objaviť v predbežných testoch, pretože v procese oddeľovania skupín môže byť Fe 2+ oxidované na Fe 3+.
Jednotlivé analytické reakcie Fe 3+ iónov
1.5.3. Hexakyanoželezitan draselný (II) K 4 s katiónmi Fe 3+ tvorí tmavomodrú zrazeninu „pruskej modrej“:
4Fe 3+ + 3Fe(CN) 6 4– → Fe 4 3 ↓.
Zrazenina je prakticky nerozpustná v kyselinách, ale rozkladá sa zásadami za vzniku Fe(OH) 3. V nadbytku činidla sa zrazenina zreteľne rozpúšťa. Vykonanie reakcie. Pridajte 1 kvapku činidla do 1–2 kvapiek roztoku FeCl 3 . Výslednú zrazeninu rozdeľte na dve časti. Do jednej časti pridajte 2-3 kvapky 2M roztoku HC1, do druhej 1-2 kvapky 2M roztoku NaOH, premiešajte.
1.5.4. Tiokyanát draselný (rodanid) KNCS s iónmi Fe 3+ tvorí krvavočervený komplex. V závislosti od koncentrácie tiokyanátu môžu tvoriť komplexy rôzneho zloženia:
Fe 3+ + NCS – ↔ Fe(NCS) 2+,
Fe 3+ + 2NCS – ↔ Fe(NCS) 2+,
atď. do Fe 3+ + 6NCS – ↔ Fe(NCS) 6 3– ,
Reakcia je reverzibilná, preto sa činidlo odoberá v nadbytku. Stanovenie rušia ióny, ktoré tvoria stabilné komplexy s Fe 3+, napríklad fluoridové ióny, soli kyseliny fosforečnej, šťaveľovej a citrónovej.
89. Prvky skupiny I B. Typické vlastnosti najdôležitejších zlúčenín, biologická úloha. Baktericídny účinok iónov Ag + a Cu 2+. Analytické reakcie na ióny striebra a medi.
n = 4 Cu ns1(n-1)d10, externá úroveň - 1 ē,
preexterná - 18 ē
n = 5 Ag Nespárované ē - jeden(porucha, pošmyknutie), ale
n = 6 Au 18 - elektrónová vrstva, stabilná v podskupine
zinok, sa tu ešte celkom nestabilizoval a
schopné stratiť ē, takže CO sú možné
Iba d-prvky skupiny IB tvoria zlúčeniny, v ktorých CO prevyšuje skupinu N a je stabilnejší pre Cu2+, Ag+, Au+3
Charakteristickou vlastnosťou iónov medi s dvojitým nábojom je ich schopnosť spájať sa s molekulami amoniaku za vzniku komplexných iónov.Meď patrí medzi stopové prvky. Fe, Cu, Mn, Mo, B, Zn, Co dostali tento názov kvôli tomu, že ich malé množstvá sú potrebné pre normálne fungovanie rastlín. Mikroelementy zvyšujú aktivitu enzýmov, podporujú syntézu cukru, škrobu, bielkovín, nukleových kyselín, vitamínov a enzýmov. Striebro je nízkoaktívny kov. Vo vzdušnej atmosfére neoxiduje ani pri izbovej teplote, ani pri zahriatí. Často pozorované sčernanie strieborných predmetov je výsledkom tvorby čierneho sulfidu strieborného - AgS 2 - na ich povrchu. K tomu dochádza pod vplyvom sírovodíka obsiahnutého vo vzduchu, ako aj pri kontakte strieborných predmetov s potravinami obsahujúcimi zlúčeniny síry 4Ag + 2H 2 S + O 2 -> 2Ag 2 S + 2H 2 OV V rozsahu napätia , striebro sa nachádza oveľa ďalej ako vodíková óda. Preto naň nemá vplyv kyselina chlorovodíková a zriedená kyselina sírová. Striebro je zvyčajne rozpustené v kyseline dusičnej, ktorá s ním interaguje podľa rovnice: Ag + 2HNO 3 -> AgNO 3 + NO 2 + H 2 O Striebro tvorí jednu sériu solí, ktorých roztoky obsahujú bezfarebné katióny Ag +. pôsobí na roztoky strieborných solí, je možné očakávať získanie AgOH, ale namiesto toho sa zráža hnedá zrazenina oxidu strieborného: 2AgNO 3 + 2NaOH -> Ag 2 O + 2NaNO 3 + H 2 O Okrem striebra (I ) oxid, známe sú oxidy AgO a Ag 2 O 3. Dusičnan strieborný (lapis ) - AgNO 3 - tvorí bezfarebné priehľadné kryštály, dobre rozpustné vo vode. Používa sa pri výrobe fotografických materiálov, pri výrobe zrkadiel, pri galvanickom pokovovaní a v medicíne.Striebro má podobne ako meď tendenciu vytvárať komplexné zlúčeniny.Veľa vo vode nerozpustných zlúčenín striebra (napríklad: oxid strieborný(I) - Ag 2 O a chlorid strieborný - Ag Cl) , ľahko rozpustné vo vodnom roztoku amoniaku Na galvanické striebro sa používajú komplexné zlúčeniny kyanidu strieborného, keďže pri elektrolýze roztokov týchto solí sa na ňom ukladá hustá vrstva jemne kryštalického striebra. Všetky zlúčeniny striebra sa ľahko redukujú uvoľňovaním kovového striebra pa. Ak sa do roztoku amoniaku oxidu strieborného v sklenenej nádobe pridá trochu glukózy alebo formalínu ako redukčného činidla, uvoľní sa kovové striebro vo forme hustej lesklej zrkadlovej vrstvy na povrchu skla. Ióny striebra potláčajú vývoj baktérií a aj vo veľmi nízkych koncentráciách sterilizujú pitnú vodu. V medicíne sa na dezinfekciu slizníc používajú koloidné roztoky striebra stabilizované špeciálnymi prísadami (protargol, collargol a pod.).Striebro (spolu s inými ťažkými kovmi ako meď, cín, ortuť) je schopné pôsobiť baktericídne účinok v malých koncentráciách (tzv. oligodynamický efekt) . Výrazný baktericídny účinok (schopnosť spoľahlivo zabíjať určité baktérie) sa pozoruje pri koncentráciách strieborných iónov nad 0,15 mg/l. V množstve 0,05 - 0,1 mg/l majú ióny striebra len bakteriostatický účinok (schopnosť inhibovať rast a rozmnožovanie baktérií).Hoci miera dezinfekcie striebra nie je taká vysoká ako v prípade ozónu alebo UV žiarenia, ióny striebra môžu zostať vo vode po dlhú dobu, čím poskytujú dlhodobú dezinfekciu. Mechanizmus účinku striebra ešte nie je úplne objasnený. Vedci sa domnievajú, že dezinfekčný účinok sa pozoruje, keď kladne nabité ióny striebra a medi vytvárajú elektrostatické väzby so záporne nabitým povrchom buniek mikroorganizmov. Tieto elektrostatické väzby vytvárajú napätie, ktoré môže zhoršiť priepustnosť buniek a znížiť prenikanie životne dôležitých množstiev živín do nich. Ióny striebra a medi prenikajú do vnútra buniek a interagujú s aminokyselinami, ktoré sú súčasťou bielkovín a používajú sa v procese fotosyntézy. V dôsledku toho je narušený proces premeny slnečného žiarenia na potravu a energiu pre mikroorganizmy, čo vedie k ich smrti.Výsledkom početných štúdií je účinný baktericídny účinok iónov striebra na väčšinu patogénnych mikroorganizmov, ale aj vírusov. bolo potvrdené. Spórotvorné odrody mikroorganizmov sú však na striebro prakticky necitlivé.Obohatenie vody iónmi striebra sa môže uskutočniť niekoľkými spôsobmi: priamym kontaktom vody s povrchom striebra, úpravou vody roztokom strieborných solí a elektrolytickým metóda.
Kvalitatívna reakcia na ióny medi
Hexakyanoželezitan draselný (2) K 4 tvorí s roztokom medenej soli červenohnedú zrazeninu Cu 2, nerozpustnú v zriedených kyselinách, ale rozpustnú v roztoku amoniaku.
Cu 2+ + 4+ ® Cu 2 ¯Do 3 kvapiek roztoku CuSO 4 pridajte 2 kvapky roztoku soli K 4 . Pozorujte tvorbu červenej zrazeniny. Odstreďte zrazeninu a pridajte do nej 3-5 kvapiek roztoku amoniaku.
Reakcie na detekciu iónov medi Cu2+
Pôsobenie skupinového činidla H2S. Sírovodík tvorí čiernu zrazeninu sírovodíka v okyslených roztokoch solí medi: CuS: CuSO4 + H2S = CuS + H2SO4,Cu2+ + H2S = CuS + 2H+.
Pôsobenie hydroxidu amónneho NH4OH. Hydroxid amónny NH4OH, užívaný v nadbytku, tvorí so soľami medi komplexný katión tetraammínovej medi (II) intenzívnej modrej farby:
CuSO4 + 4NH4OH = SO4 + 4H2O,
Cu2+ + 4NH4OH = + + 4H20.
Reakcie detekcie iónov striebra Ag+
Pôsobenie skupinového činidla HC1. Kyselina chlorovodíková tvorí s roztokmi Ag+ solí bielu zrazeninu chloridu strieborného AgCl, ktorý je prakticky nerozpustný vo vode:
Ag+ + Cl- = AgCl.
Detekcia katiónu striebra. Kyselina chlorovodíková a roztoky jej solí (t.j. Cl-chloridové ióny) tvoria s roztokmi Ag+ solí prakticky vo vode nerozpustnú bielu zrazeninu chloridu strieborného AgCl, ktorá sa dobre rozpúšťa v nadbytku roztoku NH4OH; v tomto prípade vzniká vo vode rozpustná komplexná strieborná soľ, diamínchlorid strieborný. Následným pôsobením kyseliny dusičnej sa komplexný ión zničí a opäť sa vyzráža chlorid strieborný (na jeho detekciu sa využívajú tieto vlastnosti solí striebra):
AgNO3 + HCl = AgCl + HNO3,
AgCl + 2NH4OH = Cl + 2H20,
Cl + 2HN03 = AgCl + 2NH4N03.
90. Prvky II B skupiny. Typické vlastnosti najdôležitejších zlúčenín, biologická úloha. Komplexná povaha enzýmov obsahujúcich meď a zinok. Analytické reakcie pre ióny Zn 2+.
Enzýmy sú prírodné proteínové katalyzátory. Niektoré enzýmy majú čisto bielkovinové zloženie a nepotrebujú žiadne ďalšie látky, aby prejavili svoju aktivitu. Existuje však veľká skupina enzýmov, ktorých aktivita sa objavuje len v prítomnosti určitých neproteínových zlúčenín. Tieto zlúčeniny sa nazývajú kofaktory. Kofaktormi môžu byť napríklad ióny kovov alebo organické zlúčeniny komplexnej štruktúry – zvyčajne sa nazývajú koenzýmy. Zistilo sa, že pre normálne fungovanie enzýmu je niekedy potrebný koenzým aj kovový ión, ktoré tvoria ternárny komplex spolu s molekulou substrátu. Kovy sú teda súčasťou biologických strojov ako nenahraditeľná súčasť. Na prenos zvyškov kyseliny fosforečnej sú potrebné ióny horčíka a na rovnaké účely sú potrebné aj draselné ióny; hydrolýza proteínov si vyžaduje ióny zinku atď.. Ďalej tieto otázky podrobne rozoberieme.. Enzýmy spravidla urýchľujú rovnaký typ reakcií a len niekoľko z nich pôsobí iba na jednu špecifickú a jedinú reakciu. Medzi takéto enzýmy, ktoré majú absolútnu špecifickosť, patrí najmä ureáza, ktorá rozkladá močovinu. Väčšina enzýmov nie je taká prísna pri výbere substrátu. Tá istá hydroláza je napríklad schopná katalyzovať hydrolytický rozklad niekoľkých rôznych esterov Ako sa prehlbovala chemická stránka biologického výskumu a chemici sa čoraz viac stávali pomocníkmi a spolupracovníkmi biológov, počet novoobjavených enzýmov sa neustále zvyšoval; čoskoro ich bolo treba počítať nie na desiatky, ale na stovky. Toto rozšírenie sortimentu biologických katalyzátorov spôsobilo určité ťažkosti pri klasifikácii a názvosloví enzýmov. Predtým sa enzýmy nazývali podľa substrátu, na ktorý pôsobili, s koncovkou „aza“. Ak teda enzým pôsobí na cukor maltózu, potom sa nazýval „maltáza“, ak na laktózu – „laktáza“ atď. V súčasnosti bola prijatá nomenklatúra, v ktorej názov odráža aj chemickú funkciu enzýmu. Častica „aza“ je vyhradená pre jednoduché enzýmy. Ak je do reakcie zapojený komplex enzýmov, používa sa termín „systém“.
Enzýmy sú rozdelené do šiestich tried:
Oxidoreduktázy. Sú to enzýmy, ktoré katalyzujú redoxné reakcie. Príklady oxidoreduktáz zahŕňajú pyruvátdehydrogenázu, ktorá odstraňuje vodík z kyseliny pyrohroznovej, katalázu, ktorá rozkladá peroxid vodíka atď.