Aká je absolútna hmotnosť síry? Tematické úlohy - Skúška z chémie: Test zo štátnej skúšky zvládnem na „5“! Príklady riešenia problémov
Chemické javy. Látky
- Ktorý z nasledujúcich znakov charakterizuje chemické javy: a) zmena farby; b) zmena stavu agregácie; c) zmena tvaru; d) tvorba sedimentu?
- Vyskytujú sa chemické javy počas nasledujúcich procesov: a) topenie ľadu; b) destilácia vody; c) hrdzavenie železa; d) oddelenie zmesi filtráciou; d) hnijúce jedlo?
- Ktoré z nasledujúcich látok sú jednoduché a ktoré zložité: a) oxid uhličitý; b) soľ; c) meď; d) vodík; e) hliník; e) mramor? Aký je rozdiel medzi týmito skupinami látok?
- Pri horení neznámej komplexnej látky v kyslíku vzniká oxid uhličitý a voda. Aké chemické prvky môžu byť prítomné v tejto komplexnej látke? Ktoré sú povinné? Vysvetli svoju odpoveď.
Relatívne atómové a molekulové hmotnosti. Stálosť zloženia hmoty
- Priemerná hmotnosť atómov síry je 5,31 ∙ 10 -26 kg. Vypočítajte relatívnu atómovú hmotnosť prvku síry, ak je hmotnosť atómu uhlíka 1,993 ∙ 10 -26 kg.
- Vypočítajte relatívnu molekulovú hmotnosť nasledujúcich komplexných látok: a) chlorid horečnatý MgCl 2 ; b) kyselina sírová H2S04; c) hydroxid vápenatý Ca(OH)2; d) oxid hlinitý Al203; e) kyselina boritá H3BO3; e) síran meďnatý CuS04.
- Horčík a síra sa spájajú v hmotnostnom pomere 3:4. Určte hmotnosť horčíka, ktorý bude reagovať s 20 g síry.
- Zmiešalo sa 21 g železa a 19 g síry a zmes sa zahriala. Vzhľadom na to, že železo a síra reagujú v hmotnostnom pomere 7:4, určite, ktorá z látok zostane nezreagovaná. Vypočítajte hmotnosť látky, ktorá nezreagovala.
Chemické vzorce a výpočty pomocou nich
- Vypočítajte, v akom hmotnostnom pomere sa sodík a kyslík kombinujú v zlúčenine Na20.
- Chemické zloženie zahŕňa vápnik (hmotnostný zlomok 29,4 %), síru (23,5 %) a kyslík (47,1 %). Určte vzorec tejto zlúčeniny.
- Vypočítajte hmotnostné pomery, v ktorých sa vápnik, uhlík a kyslík nachádzajú v zlúčenine CaCO 3.
- Medená ruda obsahuje minerál chalkopyrit CuFeS 2 a ďalšie nečistoty, ktorých zloženie neobsahuje meď. Hmotnostný podiel chalkopyritu v rude je 5 %. Vypočítajte hmotnostný podiel medi v tejto rude.
Valence
- Určte valenciu prvkov v nasledujúcich zlúčeninách: a) NH 3 ; b) S03; c) C02; d) H2Se; e) P203.
- Napíšte vzorce kyslíkatých zlúčenín (oxidov) nasledujúcich prvkov: a) berýlium (II); b) kremík (IV); c) draslík (I); d) arzén (V).
- Napíšte vzorce pre zlúčeniny mangánu a kyslíka, v ktorých je mangán di-, tri-, tetra- a sedemmocný.
- Nakreslite vzorce chloridu meďného (I) a chloridu meďnatého (II), berúc do úvahy, že chlór v zlúčeninách s kovmi je jednomocný.
Chemické rovnice. Typy reakcií
- Reakčná schéma CuCl 2 + KOH → Cu(OH) 2 + KCl zodpovedá výmennej reakcii. Usporiadajte koeficienty v tomto diagrame.
- Doplňte reakčné schémy a zostavte rovnice: a) Li + ... → Li 2 O; b) Al + 02 ->...; c) Na + S → ...; d) C + ... -> CCI4.
- Uveďte dva príklady každého typu reakcie: rozklad, kombinácia a substitúcia. Napíšte rovnice pre tieto reakcie.
- Napíšte reakčné rovnice medzi hliníkom a nasledujúcimi látkami: a) chlór; b) kyslík; c) síra (dvojmocná); d) jód (monovalentný).
Množstvo hmoty. Mol. Molárna hmota
- Vypočítajte množstvo horčíka vo vzorke tohto kovu s hmotnosťou 6 g.
- Aká je hmotnosť zmesi pozostávajúcej z 10 mólov plynného vodíka a 5 mólov kyslíka?
- Vypočítajte látkové množstvo obsiahnuté v 100 g nasledujúcich látok: a) fluorid lítny LiF; b) oxid kremičitý (IV) Si02; c) bromovodík HBr; d) kyselina sírová H2SO4.
- Určte hmotnosť vzorky oxidu sírového, ktorá obsahuje rovnaký počet molekúl, koľko je atómov v 1,4 g kúsku železa.
Výpočty pomocou chemických rovníc
- Interakciou vodíka a kyslíka vzniklo 450 g vody. Aká je hmotnosť plynov, ktoré reagovali?
- Keď sa vápenec (uhličitan vápenatý) kalcinuje CaCO 3, vzniká oxid vápenatý a oxid uhličitý. Akú hmotnosť vápenca treba odobrať na získanie 7 kg oxidu vápenatého?
- Pri interakcii 13,44 g železa s chlórom vznikol jeden z chloridov železa s hmotnosťou 39 g. Určte valenciu železa vo výslednom chloride a napíšte vzorec zlúčeniny.
- Hliník s hmotnosťou 10,8 g bol tavený so sivou hmotou 22,4 g Vypočítajte množstvo sulfidu hlinitého Al 2 S 3, ktorý sa vytvorí ako výsledok reakcie.
Uveďte hlavné ustanovenia atómovo-molekulárneho vyučovania.
1. Látky pozostávajú z molekúl. Molekula je najmenšia častica látky, ktorá si zachováva svoje chemické vlastnosti. Molekuly rôznych látok majú rôznu hmotnosť, veľkosť, zloženie a chemické vlastnosti.
2. Molekuly sa skladajú z atómov. Atóm je najmenšia častica látky, chemického prvku, ktorá si zachováva svoje chemické vlastnosti. Chemický prvok je samostatný typ atómu. Chemické vlastnosti prvku sú určené štruktúrou jeho atómov. Všetky chemické prvky sú rozdelené na kovy a nekovy.
3. Látky, ktorých molekuly pozostávajú z atómov jedného prvku, sa nazývajú jednoduché (H 2 ; O 2). Látky, ktorých molekuly pozostávajú z atómov rôznych prvkov, sa nazývajú komplexné (HCl). Alotropické zmeny sú zmeny, pri ktorých sú jedným prvkom tvorené rôzne jednoduché látky. Alotropia je tvorba rôznych jednoduchých látok jedným prvkom.
Dôvod alotropie:
a) rôzne počty atómov (02 a 03);
b) tvorba kryštálov rôznych modifikácií (diamant a grafit);
4. Molekuly a atómy sú v nepretržitom pohybe. Rýchlosť pohybu závisí od stavu agregácie látky. Chemické reakcie sú chemickou formou pohybu atómov a molekúl.
V dôsledku chemických reakcií sa molekuly niektorých látok premieňajú na molekuly iných látok. Dôležitou charakteristikou látky je hmotnosť.
Otázka č.2
Aké sú podobnosti a rozdiely v pojmoch „atómová hmotnosť“ a „relatívna hmotnosť“?
1. Absolútna atómová hmotnosť je hmotnosť gramu vyjadrená v gramoch (g) alebo kilogramoch (kg)
m a () = 1,67 x 10-24 g
Je nepohodlné používať takéto čísla, preto sa používajú relatívne atómové hmotnosti.
2. Relatívna atómová hmotnosť ukazuje, koľkokrát je hmotnosť daného atómu väčšia ako 1/12 hmotnosti atómu uhlíka.
1/12 hmotnosti atómu uhlíka sa nazýva jednotka atómovej hmotnosti (a.u.m.)
1 amu = ma (C)/12 = (1,99*10-23)/12 g = 1,66*10-24 g
ar() = ma (H)/1 a.u.m = (1,67*10-27 / 1,66*10-24) = 1
Relatívna atómová hmotnosť, na rozdiel od absolútnej hmotnosti, nemá mernú jednotku.
Otázka č.3
Je možné spojiť pojmy „krtek“ a „Avogadrova konštanta“?
Mol je množstvo látky, ktoré obsahuje 6,02 * 10 23 častíc (molekúl alebo atómov).
Hodnota 6,02 * 10 23 mol-1 sa nazýva Avogadrova konštanta, ktorá sa označuje ako Na
n = N/Na, kde
n - množstvo hmoty;
N je počet atómov alebo molekúl.
Otázka č.4
Porovnajte počet atómov obsiahnutých v chlóre a dusíku s hmotnosťou po 10 g. V ktorom prípade a koľkokrát je počet atómov väčší?
|
Vzhľadom na to: m(Cl2)= 10 g m(N2) = 10 g ___________ N Cl2 – ? N N – ? |
Riešenie M(CI2) = 35,5*2 = 71 g/mol n (Cl2) = m(Cl2)/M(Cl2) = 10 g/71 g/mol = = 0,14 mol N(CI2) = n(CI2) * Na = 0,14 mol |
|
6,02*10-23 1/mol M(N2) = 14 x 2 = 28 g/mol n (N2) = m(N2)/M(Cl2) = 10 g/28 g/mol = 0,36 mol N(N2) = n (N2) * Na = 0,36 mol * 6,02 * 1023 1/mol = 2,17 * 1023 N(Cl2) = (2,17 x 1023) /0,843 x 1023 = 2,57 Odpoveď: N (N2) > N (Cl2) 2,57 krát |
|
Otázka č.5
Priemerná hmotnosť atómov síry je 5,31 * 10-26 kg. Vypočítajte relatívnu atómovú hmotnosť prvku síry. Hmotnosť atómu uhlíka – 12 sa rovná 1,993 * 10 -26 kg.
|
Vzhľadom na to: m a (S) = 5,31 x 10-26 kg m a (C) = 1,993 x 10-26 kg ___________ ar(s) – ? |
Riešenie 1 amu = ma (C) /12 = (1,993*10-26 kg) = 1,66*10-27 kg ar (s) = m a (S)/1 a.m.u. = 5,31 x 10-26 kg = 32 Odpoveď: ar(s) = 32. |
Otázka č.6
Vzorka látky s hmotnosťou 6,6 g obsahuje 9,03 * 10 22 molekúl. Určte molekulovú hmotnosť tejto látky.
Otázka č.7
Uveďte počiatočnú a modernú formuláciu periodického zákona. Aký je dôvod ich rozdielu?
Počiatočná formulácia: charakteristika jednoduchých telies a tvary a vlastnosti zlúčenín prvkov sú periodicky závislé od veľkosti atómových hmotností prvkov.
Moderná formulácia: vlastnosti jednoduchých látok, ako aj formy a vlastnosti zlúčenín prvkov sú periodicky závislé od veľkosti náboja atómového jadra (atómového čísla).
V periodickej tabuľke nie sú všetky prvky usporiadané podľa rastúcej atómovej hmotnosti; existujú výnimky, ktoré nedokázal vysvetliť. Predvídal, že dôvod spočíva v zložitosti štruktúry atómov. Objav a štúdium izotopov ukázali, že chemické vlastnosti všetkých izotopov jedného prvku sú rovnaké, čo znamená, že chemické vlastnosti prvku nezávisia od atómovej hmotnosti, ale od náboja jadra.
Otázka č.8
Predstavte si elektronické konfigurácie hliníka a skandia. Vysvetlite, prečo sú umiestnené v rovnakej skupine „periodickej tabuľky“? Prečo sú zaradené do rôznych podskupín? Sú to elektronické analógy?
aL a Se majú tri valenčné elektróny, takže sú v rovnakej skupine.
aL označuje p-prvky a Se označuje d-prvky, takže sa nachádzajú v rôznych podskupinách a nie sú elektronickými analógmi.
Otázky č.9
Medzi elektronickými konfiguráciami uvedenými nižšie uveďte nemožné a vysvetlite dôvod nemožnosti ich implementácie
1R 3; 3p 6; 3S2; 2S2; 2d5; 5d2; 2p4; 3p 7
Otázka č.10
Symbol izotopu prvku. Zadajte názov prvku; počet neutrónov a protónov; počet elektrónov v elektrónovom obale atómu.
Tento prvok s atómovým číslom 92 a relatívnou hmotnosťou 238 je urán.
Počet protónov je 92 a počet neutrónov je určený rozdielom medzi relatívnou atómovou hmotnosťou a atómovým číslom, ktorý sa rovná 238 – 92 = 146. Číslo e je určené poradovým číslom prvku a rovná sa 92.
Otázka č.11
Jadro atómu niektorého prvku obsahuje 16 neutrónov a elektrónový obal obsahuje 15 elektrónov. Pomenujte prvok, ktorého izotopom je tento atóm. Uveďte symbol tohto chemického prvku a uveďte jadrový náboj a hmotnostné číslo.
Fosfor (P) je prvok obsahujúci 15 elektrónov.
Hmotnosť atómu je určená súčtom hmotností protónov a neutrónov.
Keďže jadro atómu obsahuje 16 neutrónov a 15 protónov, jeho hmotnostné číslo je 31. A dá sa to zapísať v nasledujúcom tvare:
POUŽITÉ KNIHY
- Kvantitatívne charakteristiky látky
- Riešenie kombinovaných problémov na základe kvantitatívnych charakteristík látky
- Riešenie problémov. Zákon stálosti zloženia látok. Výpočty využívajúce pojmy „molárna hmotnosť“ a „chemické množstvo“ látky
- Riešenie výpočtových úloh na základe kvantitatívnych charakteristík hmoty a stechiometrických zákonov
- Riešenie výpočtových úloh na základe zákonitostí plynného stavu látky
Achmetov N.S. Všeobecná a anorganická chémia.
Pilipenko. Príručka elementárnej chémie.
Khomchenko I.G. všeobecná chémia
1. Doplňte medzery vo vetách.
Absolútna atómová hmotnosť znázorňuje hmotnosť jednej dvanástky časti 1/12 hmotnosti jednej molekuly izotopu uhlíka 12 6 C meranú v týchto jednotkách: g, gk, mg, t.j.
Relatívna atómová hmotnosť ukazuje, koľkokrát je hmotnosť danej látky prvku väčšia ako hmotnosť atómu vodíka; nemá mernú jednotku.
2. Pomocou zápisu zapíšte hodnotu zaokrúhlenú na celé číslo:
a) relatívna atómová hmotnosť kyslíka - 16:
b) relatívna atómová hmotnosť sodíka - 23;
c) relatívna atómová hmotnosť medi - 64.
3. Uvádzajú sa názvy chemických prvkov: ortuť, fosfor, vodík, síra, uhlík, kyslík, draslík, dusík. Do prázdnych buniek napíšte symboly prvkov tak, aby ste dostali riadok, v ktorom sa relatívna atómová hmotnosť zvyšuje.
4. Podčiarknite pravdivé tvrdenia.
a) Hmotnosť desiatich atómov kyslíka sa rovná hmotnosti dvoch atómov brómu;
b) hmotnosť piatich atómov uhlíka je väčšia ako hmotnosť troch atómov síry;
c) Hmotnosť siedmich atómov kyslíka je menšia ako hmotnosť piatich atómov horčíka.
5. Vyplňte schému.

6. Vypočítajte relatívne molekulové hmotnosti látok na základe ich vzorcov:
a) Mr (N2) = 2 x 14 = 28
b) Mr (CH4) = 12 + 4 x 1 = 16
c) Mr (CaC03) = 40+12+3*16=100
d) Mr (NH4CI) = 12+41+35,5=53,5
e) Mr (H3P04) = 3*1+31+16*4=98
7. Pred vami je pyramída, ktorej „stavebnými kameňmi“ sú vzorce chemických zlúčenín. Nájdite cestu z vrcholu pyramídy k jej základni tak, aby súčet relatívnych molekulových hmotností zlúčenín bol minimálny. Pri výbere každého ďalšieho „kameňa“ musíte vziať do úvahy, že si môžete vybrať iba ten, ktorý priamo susedí s predchádzajúcim.

Ako odpoveď napíšte vzorce látok vo výhernej ceste.
Odpoveď: C2H6-H2C03-S02-Na2S
8. Kyselina citrónová sa nachádza nielen v citrónoch, ale aj v nezrelých jablkách, ríbezliach, čerešniach atď. Kyselina citrónová sa používa pri varení a v domácnosti (napríklad na odstránenie škvŕn od hrdze z látky). Molekula tejto látky pozostáva zo 6 atómov uhlíka, 8 atómov vodíka, 7 atómov kyslíka.
C6H807
Skontrolujte správne vyhlásenie:
a) relatívna molekulová hmotnosť tejto látky je 185;
b) relatívna molekulová hmotnosť tejto látky je 29;
c) relatívna molekulová hmotnosť tejto látky je 192.
DEFINÍCIA
Síra- šestnásty prvok periodickej tabuľky. Označenie - S z latinského "síra". Nachádza sa v tretej tretine, skupina VIA. Vzťahuje sa na nekovy. Jadrový náboj je 16.
Síra sa v prírode vyskytuje ako vo voľnom stave (natívna síra), tak aj v rôznych zlúčeninách. Veľmi bežné sú zlúčeniny síry s rôznymi kovmi. Mnohé z nich sú cenné rudy (napr. olovnatý lesk PbS, zinková zmes ZnS, medený lesk Cu 2 S) a slúžia ako zdroj farebných kovov.
Zo zlúčenín síry sú v prírode bežné aj sírany, hlavne vápnik a horčík, napokon zlúčeniny síry sa nachádzajú v organizmoch rastlín a živočíchov.
Atómová a molekulová hmotnosť síry
Relatívna molekulová hmotnosť látky (M r) je číslo, ktoré ukazuje, koľkokrát je hmotnosť danej molekuly väčšia ako 1/12 hmotnosti atómu uhlíka a relatívna atómová hmotnosť prvku(A r) - koľkokrát je priemerná hmotnosť atómov chemického prvku väčšia ako 1/12 hmotnosti atómu uhlíka.
Hodnoty atómových a molekulových hmotností síry sú rovnaké; rovnajú sa 32,059.
Alotropia a alotropné modifikácie síry
Síra existuje vo forme dvoch alotropných modifikácií – ortorombickej a monoklinickej.
Za normálneho tlaku tvorí síra krehké žlté kryštály, ktoré sa topia pri 112,8 o C; hustota je 2,07 g/cm3. Je nerozpustný vo vode, ale celkom rozpustný v sírouhlíku, benzéne a niektorých ďalších kvapalinách. Pri odparovaní týchto kvapalín sa z roztoku uvoľňuje síra vo forme žltých kryštálov ortorombickej sústavy v tvare osemstenov, v ktorých sú zvyčajne odrezané niektoré rohy alebo okraje (obr. 1). Táto modifikácia síry sa nazýva kosoštvorcová.
Ryža. 1. Alotropické modifikácie síry.
Kryštály iného tvaru sa získajú, ak sa roztavená síra pomaly ochladí a keď čiastočne stuhne, kvapalina, ktorá ešte nestihla stuhnúť, sa vypustí. Za týchto podmienok sú steny nádoby zvnútra pokryté dlhými tmavožltými ihličkovitými kryštálmi jednoklonnej sústavy. Táto modifikácia síry sa nazýva monoklinická. Má hustotu 1,96 g/cm3, topí sa pri 119,3 o C a je stabilný len pri teplotách nad 96 o C.
Izotopy síry
Je známe, že v prírode sa síra nachádza vo forme štyroch stabilných izotopov 32S, 33S, 34S a 36S. Ich hmotnostné čísla sú 32, 33, 34 a 36. Jadro atómu izotopu síry 32S obsahuje šestnásť protónov a šestnásť neutrónov a izotopy 33S, 34S a 36S obsahujú rovnaký počet protónov, sedemnásť, osemnásť a dvadsať neutrónov.
Existujú umelé izotopy síry s hmotnostnými číslami od 26 do 49, z ktorých najstabilnejší je 35 S s polčasom rozpadu 87 dní.
Ióny síry
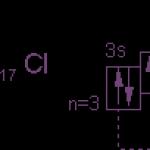
Vonkajšia energetická hladina atómu síry má šesť elektrónov, ktoré sú valenčnými elektrónmi:
1s 2 2s 2 2p 6 3s 2 3p 4 .
V dôsledku chemickej interakcie môže síra stratiť svoje valenčné elektróny, t.j. byť ich donorom, a premeniť sa na kladne nabité ióny alebo prijať elektróny z iného atómu, t.j. byť ich akceptorom a premeniť sa na záporne nabité ióny:
S°-6e → S6+;
S°-4e → S4+;
S°-4e → S2+;
S o +2e → S 2-.
Molekula a atóm síry
Molekula síry je monatomická - S. Tu sú niektoré vlastnosti, ktoré charakterizujú atóm a molekulu síry:
Príklady riešenia problémov
PRÍKLAD 1
| Cvičenie | Aké množstvo síry bude potrebné na získanie sulfidu hlinitého Al 2 S 3 s hmotnosťou 30 g? Za akých podmienok možno tento sulfid získať z jednoduchých látok? |
| Riešenie | Napíšme reakčnú rovnicu na výrobu sírnika: 2Al + 3S = Al2S3. Vypočítajme množstvo látky sulfidu hlinitého (mólová hmotnosť - 150 g/mol): n(A12S3) = m(A12S3)/M(A12S3); n(Al2S3) = 30/150 = 0,2 mol. Podľa reakčnej rovnice n(Al 2 S 3) : n(S) = 1:3 to znamená: n(S) = 3 x n(Al2S3); n(S) = 3 x 0,2 = 0,6 mol. Potom bude hmotnosť síry rovnaká (molárna hmotnosť - 32 g / mol): m(S) = n(S) x M(S); Relatívna atómová hmotnosť (A r) - bezrozmerné množstvo rovnajúce sa pomeru priemernej hmotnosti atómu prvku (berúc do úvahy percento izotopov v prírode) k 1/12 hmotnosti atómu 12 C. Priemerná absolútna atómová hmotnosť (m) rovná relatívnej atómovej hmotnosti krát amu. Ar(Mg) = 24,312 m (Mg) = 24,312 1,66057 10 -24 = 4,037 10 -23 g Relatívna molekulová hmotnosť (Pán) - bezrozmerná veličina udávajúca, koľkokrát je hmotnosť molekuly danej látky väčšia ako 1/12 hmotnosti atómu uhlíka 12 C. Mg = mg / (1/12 m a (12 C)) Pán - hmotnosť molekuly danej látky; m a (12 C) - hmotnosť atómu uhlíka 12 C. Mg = SA g (e). Relatívna molekulová hmotnosť látky sa rovná súčtu relatívnych atómových hmotností všetkých prvkov, berúc do úvahy indexy. Príklady. Mg (B203) = 2 Ar (B) + 3 Ar (O) = 2 11 + 3 16 = 70 Mg(KAl(S04)2) = 1 Ar (K) + 1 Ar (Al) + 1 2 Ar (S) + 2 4 Ar (O) = Absolútna molekulová hmotnosť rovná relatívnej molekulovej hmotnosti vynásobenej amu. Počet atómov a molekúl v bežných vzorkách látok je veľmi veľký, preto sa pri charakterizácii množstva látky používa špeciálna jednotka merania - krtek. Látkové množstvo, mol . Znamená určitý počet štruktúrnych prvkov (molekuly, atómy, ióny). Určenén , merané v móloch. Mol je množstvo látky obsahujúcej toľko častíc, koľko je atómov v 12 g uhlíka. Avogadroovo číslo (N A ). Počet častíc v 1 mol akejkoľvek látky je rovnaký a rovná sa 6,02 10 23. (Avogadrova konštanta má rozmer - mol -1). Príklad. Koľko molekúl je v 6,4 g síry? Molekulová hmotnosť síry je 32 g/mol. Stanovíme množstvo g/mol látky v 6,4 g síry: n ( s) = m(s)/M(s ) = 6,4 g / 32 g/mol = 0,2 mol Určme počet štruktúrnych jednotiek (molekúl) pomocou konštanty Avogadro N A N(s) = n (s)NA = 0,2 6,02 10 23 = 1,2 10 23 Molárna hmota ukazuje hmotnosť 1 mólu látky (označM). M = m / n Molárna hmotnosť látky sa rovná pomeru hmotnosti látky k zodpovedajúcemu množstvu látky. Molárna hmotnosť látky sa číselne rovná jej relatívnej molekulovej hmotnosti, avšak prvá veličina má rozmer g/mol a druhá je bezrozmerná. M = NA m (1 molekula) = N A M g 1 amu = (NAi amu) Mg = Mg To znamená, že ak je hmotnosť určitej molekuly napríklad 80 amu. ( TAK 3 ), potom sa hmotnosť jedného mólu molekúl rovná 80 g. Avogadrova konštanta je koeficient úmernosti, ktorý zabezpečuje prechod z molekulových vzťahov na molárne. Všetky tvrdenia týkajúce sa molekúl zostávajú platné pre móly (v prípade potreby s nahradením amu za g). Napríklad reakčná rovnica: 2 Na + Cl 2 2 NaCl , znamená, že dva atómy sodíka reagujú s jednou molekulou chlóru alebo, čo je to isté, dva móly sodíka reagujú s jedným mólom chlóru. NavigáciaOdporúčame tiež |