Rovnica materiálovej bilancie RIV v závere reaktora. IV
Všeobecná rovnica tepelnej bilancie chemického reaktora. Rovnica tepelnej bilancie pre chemické reaktory pracujúce v izotermickom, adiabatickom a strednom tepelnom režime. Tepelná stabilita chemických reaktorov v prípade exo- a endotermických reakcií. Reaktor s reverzibilnou reakciou.
Rovnica tepelnej bilancie berie do úvahy všetky tepelné toky vstupujúce a vystupujúce z reaktora. Takéto toky sú: Qin – fyzikálne teplo reakčnej zmesi zahrnuté v elementárnom objeme, pre ktorý sa zostavuje bilancia (vstupný tok); Qout – fyzikálne reakčné teplo opúšťajúce elementárny objem (výstupný tok); Q р – teplo chemickej reakcie (znamienko môže byť kladné alebo záporné); Q t.o – teplo vynaložené na výmenu tepla s okolím (v závislosti od pomerov teplôt v reaktore a v prostredí alebo v teplovýmennom zariadení môže byť toto prúdenie smerované aj do objemu a von z neho); Q f.pr – teplo fázových premien.
Pre stacionárny prevádzkový režim reaktora je algebraický súčet všetkých tepelných tokov rovný nule: Q in - Q out ± Q r ± Q t.o ± Q f.pr = 0 (1)
V nestabilnom režime dochádza k pozitívnej alebo negatívnej akumulácii tepla v elementárnom objeme:
Q in - Q out ± Q r ± Q t.o ± Q f.pr = Q nak (2)
Rovnice (1) a (2) sú všeobecné rovnice pre tepelnú bilanciu chemického reaktora. Existuje niekoľko typov tepelných režimov chemických reakcií a podľa toho aj špecifické typy rovníc tepelnej bilancie
I. Izotermický - režim charakterizovaný tým, že teplota na vstupe, vnútri a na výstupe je rovnaká. To je možné, ak sa uvoľňovanie a absorpcia tepla v dôsledku chemickej reakcie kompenzuje výmenou tepla s prostredím. Pre stacionárny izotermický dej s konštantnými fyzikálnymi vlastnosťami systému môžeme písať: Q in =Q out; | Q р |=| Q t.o | .
Okrem zásadne izotermických zmiešavacích reaktorov sa k izotermii môžu priblížiť reaktory s veľmi nízkou hodnotou Q p, CA0 alebo x (stupeň konverzie) s výraznou tepelnou vodivosťou v reakčnej zmesi. Pri modelovaní reaktorov medzi úplne izotermické reaktory patria reaktory rôznych typov, zmiešavacieho kvapalného typu (Zh, Zh-Zh, Zh-T). Izotermický režim sa pozoruje na polici malých penových a prebublávacích prístrojov, ako aj vo fluidnom lôžku zrnitého materiálu a iných prístrojoch.
Charakteristická rovnica izotermického reaktora: t cf =t k =konšt.
II. Adiabatický režim je charakterizovaný úplnou absenciou výmeny tepla s okolím. V tomto prípade sa všetko teplo chemickej reakcie spotrebuje na zahrievanie alebo chladenie reakčnej zmesi. Pre stacionárny proces |Q in -Q out |=|Q p |. Zmena teploty v adiabatickom reaktore ∆t je priamo úmerná stupňu konverzie x, koncentrácii hlavného činidla C A0 a tepelnému účinku reakcie Q p. Zmeny teploty sú pozitívne pre exotermické reakcie a negatívne pre endotermické reakcie. Rovnica tepelnej bilancie pre reakciu A→B bude: G c t k ± GQ p CA 0 x=G c t k(2), odtiaľ získame charakteristickú rovnicu: ± GQ p C A 0 x=с (t k – t n) (2’).
Zmena teploty v ktoromkoľvek úseku pozdĺž osi prúdenia v reaktore s piestovým tokom je úmerná stupňu konverzie: ∆t= t k – t n =±λх, kde λ je koeficient adiabatickej zmeny teploty: λ=(Q p * C D)/c, kde
C D – koncentrácia produktu. Rovnica tepelnej bilancie pre elementárnu časť reaktora bude: ±Q p C A dx A =cdt (3). Pre plne zmiešaný reaktor je rovnica tepelnej bilancie rovnaká ako (2').
III. Stredne pokročilý(polytropický alebo autotermálny) režim je charakteristický tým, že časť reakčného tepla sa vynakladá na zmenu obsahu tepla (ohrievanie alebo ochladzovanie) reakčnej zmesi a čiastočne na výmenu tepla s okolím. Tento režim sa najčastejšie nachádza v TCP. Tento režim je opísaný úplnou rovnicou tepelnej bilancie. Pri konštantnej hmotnostnej tepelnej kapacite a ustálenom stave bude teplo uvoľnené (absorbované) v dôsledku reakcie pri stupni premeny x A odvedené reakčnými produktmi a prenesené cez stenu reaktora: ±GQ p C A 0 x A =G c (t k – t n) ± k t F∆t av (4), odtiaľto možno zistiť: 1) zmenu teploty (t k – t n), stupeň premeny (x A), teplovýmennú plochu (F ). Táto rovnica (4) bola získaná pre zmiešavací reaktor a pre reaktor s piestovým tokom, v ktorom je teplota rovnaká po celej dĺžke, to znamená, že teplota chladiacej kvapaliny alebo chladiacej kvapaliny umiestnenej v plášti je konštantná po celej dĺžke reaktora; teplota reaktantov je v ktoromkoľvek bode prierezu reaktora rovnaká. Od teploty v reaktore sa mení pozdĺž jeho dĺžky, tepelná bilancia sa zostavuje pre elementárny úsek dĺžky reaktora (∆H): GQ p C A 0 x A =G c dt± k t F’(t-t arr)dH; kde t je teplota v uvažovanom reaktorovom prvku; t okolitá – teplota v bunde.
Porovnanie charakteristík izotermických, adiabatických a polytermálnych procesov je znázornené na obrázkoch.
Stabilita prevádzky reaktora je jednou z požiadaviek, ktoré sú na ne kladené. Podľa A.M. Lyapunova „Systém sa nazýva stabilný, ak sa po aplikácii nejakého rušenia vráti do predchádzajúceho stavu, keď sa toto rušenie odstráni.“
Najdôležitejšia je teplotná (tepelná) stabilita chemických reakcií a reaktorov. Pri exo- a endotermických reakciách dochádza k automatickej regulácii teploty technologického procesu vplyvom koncentrácie činidiel v chemickom procese. V niektorých prípadoch je závislosť množstva uvoľneného tepla od teploty v kompletnom fúznom reaktore pri reverzibilná exotermická reakcia.
Stabilita technologického režimu reaktora môže byť určená jeho citlivosťou pri zmene jedného alebo druhého parametra a je tzv parametrická citlivosť:П=dy/dx, kde y je vstupná hodnota - parameter (teplota, spotreba činidla, koncentrácia), x je výstupná hodnota - parameter charakterizujúci výsledok procesu (stupeň premeny, teplota, reakčný čas).
V RIS sú všetky objemové parametre konštantné.
Všetky vlastnosti (koncentrácia S, stupeň premeny X A, teplota T atď.) plynulo meniť v celom objeme reaktora, preto sa nedá zostaviť materiálová bilancia pre celý objem reaktora.

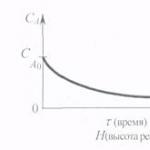
Ryža. 2. Grafy závislosti:
A) CA =f (τ alebo H)b) w= f (τ alebo H) V) X A = f (τ alebo H)
 - rýchlosť procesu na jednotku objemu
- rýchlosť procesu na jednotku objemu
Vyberie sa nekonečne malý objem reaktora dV a zostaví sa preň materiálová bilancia. Tieto nekonečne malé objemy sú potom integrované do celého objemu reaktora.
Nech v reaktore prebehne jednoduchá ireverzibilná reakcia bez zmeny objemu υ:
Kde , S A - počiatočné a aktuálne koncentrácie;
υ - objemový prietok
![]()
Kde V- objem reaktora (m3);
dV je elementárny objem reaktora (m 3).
Poďme si to zhrnúť:
(prichádza) 

 -
Matematická rovnica rovnováhu
-
Matematická rovnica rovnováhu
elementárny objem RIV-N
Na získanie rovnice matemat. bilancie celého reaktora, výslednú rovnicu integrujeme po oddelení premenných (cez objem celého reaktora):

 -
Charakteristická rovnica RIV-N.
-
Charakteristická rovnica RIV-N.
Kde w A zistíme, keď poznáme kinetiku procesu.
Charakteristická rovnica RIV-N umožňuje poznať kinetiku procesu
(nájsť w A), určiť časτ zotrvanie činidiel v pomere reaktora na dosiahnutie špecifikovaného stupeň premeny X A a potom rozmery reaktora.
Na reakciu n-tý objednať :
 ,
,
Kde P - poradie reakcie.
O n=0:
O n=1:


Závisí len od stupňa konverzie X A a nezávisí od počiatočnej koncentrácie;
O n=2:



V niektorých výroby reaktory stupeň konverzie X A je taká nevýznamná, že model možno použiť na výpočet RIV- Toto rúrkové kontaktné zariadenia s katalyzátorom v rúrkach alebo medzikruží ("škrupina a rúrka"), slúžiace na heterogénne reakcie v plynnej fáze.
Model represie používa sa aj v dizajne rúrkové reaktory v kvapalnej fáze s veľkým pomerom dĺžky potrubia k jeho priemeru.
Za rovnakých podmienok na uskutočnenie rovnakej reakcie, aby sa dosiahla rovnaká hĺbka konverzie, je priemerný čas zotrvania reaktantov v prietokovom ideálnom zmiešavacom reaktore dlhší ako v reaktore s piestovým tokom. V RIS sa koncentrácie vo všetkých bodoch rovnajú konečnej koncentrácii a v RIV sú koncentrácie činidiel v 2 susedných bodoch odlišné. Reakčná rýchlosť je podľa ZDM úmerná koncentrácii činidiel. Preto je v RIV vždy vyššia ako v RIS. Tie. Na dosiahnutie rovnakej hĺbky konverzie je potrebný kratší čas zotrvania.
Chemické reaktory üKoncept chemického reaktora. Klasifikácia chemických reaktorov a ich prevádzkové režimy. üMateriálové a tepelné bilancie reaktorov. üMatematické modely procesov v ideálnych reaktoroch. -Perfektný miešací vsádzkový reaktor (RIS-P). üKontinuálny reaktor (prietokové reaktory). - Zátkový prietokový reaktor (PPR). - Kontinuálny ideálny miešací reaktor (RIS-N). - Kaskáda ideálnych miešacích reaktorov (K-RIS). üPorovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom. üPorovnanie selektivity prietokových reaktorov. üTeplotné prevádzkové podmienky reaktorov. üPorovnanie reaktorov podľa teplotných podmienok.
 Chemický reaktor je zariadenie, v ktorom sa uskutočňujú chemické procesy, ktoré kombinujú chemické reakcie s prenosom hmoty a tepla. Základné požiadavky na priemyselné reaktory: 1. Maximálna produktivita a náročnosť práce 2. Vysoká výťažnosť produktu a najvyššia selektivita procesu. Zabezpečuje ich optimálny prevádzkový režim reaktora: teplota, tlak, koncentrácia východiskových látok a reakčných produktov. Katalytický reaktor musí tiež zabezpečiť efektívne využitie katalyzátora. 3. Minimálne energetické náklady na miešanie a dopravu materiálov cez reaktor, ako aj čo najlepšie využitie tepla exotermických reakcií alebo tepla dodávaného do reaktora na ohrev reagujúcich látok na optimálne teploty. 4. Jednoduchá ovládateľnosť a bezpečná prevádzka. Tieto podmienky sú zabezpečené racionálnym návrhom reaktora a malými výkyvmi parametrov technologického režimu, ktoré umožňujú jednoduchú automatizáciu prevádzky reaktora. 5. Nízke náklady na výrobu reaktora a jeho opravu. 6. Stabilita prevádzky reaktora s výraznými zmenami hlavných parametrov režimu (C, T, P, Ak. ω).
Chemický reaktor je zariadenie, v ktorom sa uskutočňujú chemické procesy, ktoré kombinujú chemické reakcie s prenosom hmoty a tepla. Základné požiadavky na priemyselné reaktory: 1. Maximálna produktivita a náročnosť práce 2. Vysoká výťažnosť produktu a najvyššia selektivita procesu. Zabezpečuje ich optimálny prevádzkový režim reaktora: teplota, tlak, koncentrácia východiskových látok a reakčných produktov. Katalytický reaktor musí tiež zabezpečiť efektívne využitie katalyzátora. 3. Minimálne energetické náklady na miešanie a dopravu materiálov cez reaktor, ako aj čo najlepšie využitie tepla exotermických reakcií alebo tepla dodávaného do reaktora na ohrev reagujúcich látok na optimálne teploty. 4. Jednoduchá ovládateľnosť a bezpečná prevádzka. Tieto podmienky sú zabezpečené racionálnym návrhom reaktora a malými výkyvmi parametrov technologického režimu, ktoré umožňujú jednoduchú automatizáciu prevádzky reaktora. 5. Nízke náklady na výrobu reaktora a jeho opravu. 6. Stabilita prevádzky reaktora s výraznými zmenami hlavných parametrov režimu (C, T, P, Ak. ω).
 Chemické reaktory Pre výber konštrukcie a určenie veľkosti akéhokoľvek reaktora sú potrebné tieto údaje: – hodnoty charakterizujúce rýchlosť chemických reakcií, ako aj rýchlosť prenosu hmoty a tepla; – vonkajšie obmedzenia spôsobené technologickým zariadením, ako je model reaktora, ktorý určuje jeho hydrodynamické charakteristiky a rýchlosť procesov prenosu hmoty a tepla. Hlavnou úlohou pri štúdiu procesov prebiehajúcich v reaktoroch akéhokoľvek typu je stanoviť funkčnú závislosť doby zotrvania činidiel v reaktore od rôznych faktorov: = f [x, C, v], kde x je daný stupeň konverzia činidla; C je počiatočná koncentrácia činidla; v je rýchlosť chemickej reakcie. Rovnica spájajúca štyri menované veličiny sa nazýva charakteristická rovnica reaktora.
Chemické reaktory Pre výber konštrukcie a určenie veľkosti akéhokoľvek reaktora sú potrebné tieto údaje: – hodnoty charakterizujúce rýchlosť chemických reakcií, ako aj rýchlosť prenosu hmoty a tepla; – vonkajšie obmedzenia spôsobené technologickým zariadením, ako je model reaktora, ktorý určuje jeho hydrodynamické charakteristiky a rýchlosť procesov prenosu hmoty a tepla. Hlavnou úlohou pri štúdiu procesov prebiehajúcich v reaktoroch akéhokoľvek typu je stanoviť funkčnú závislosť doby zotrvania činidiel v reaktore od rôznych faktorov: = f [x, C, v], kde x je daný stupeň konverzia činidla; C je počiatočná koncentrácia činidla; v je rýchlosť chemickej reakcie. Rovnica spájajúca štyri menované veličiny sa nazýva charakteristická rovnica reaktora.
 Chemické reaktory Klasifikácia chemických reaktorov a ich prevádzkové režimy Najčastejšie sa používajú tieto znaky klasifikácie chemických reaktorov a ich prevádzkové režimy: 1) spôsob pohybu reakčného média (hydrodynamická situácia v reaktore); 2) podmienky výmeny tepla v reaktore; 3) fázové zloženie reakčnej zmesi; 4) spôsob organizácie procesu; 5) charakter zmien parametrov procesu v priebehu času; 6) konštrukčné vlastnosti. 1) Klasifikácia reaktorov podľa hydrodynamických podmienok. V závislosti od hydrodynamickej situácie možno všetky reaktory rozdeliť na zmiešavacie a vytesňovacie reaktory. Miešacie reaktory sú kapacitné zariadenia s miešaním pomocou mechanického miešadla alebo obehového čerpadla. Vytesňovacie reaktory sú rúrkové zariadenia, ktoré vyzerajú ako predĺžený kanál.
Chemické reaktory Klasifikácia chemických reaktorov a ich prevádzkové režimy Najčastejšie sa používajú tieto znaky klasifikácie chemických reaktorov a ich prevádzkové režimy: 1) spôsob pohybu reakčného média (hydrodynamická situácia v reaktore); 2) podmienky výmeny tepla v reaktore; 3) fázové zloženie reakčnej zmesi; 4) spôsob organizácie procesu; 5) charakter zmien parametrov procesu v priebehu času; 6) konštrukčné vlastnosti. 1) Klasifikácia reaktorov podľa hydrodynamických podmienok. V závislosti od hydrodynamickej situácie možno všetky reaktory rozdeliť na zmiešavacie a vytesňovacie reaktory. Miešacie reaktory sú kapacitné zariadenia s miešaním pomocou mechanického miešadla alebo obehového čerpadla. Vytesňovacie reaktory sú rúrkové zariadenia, ktoré vyzerajú ako predĺžený kanál.
 Chemické reaktory 2) Klasifikácia podľa podmienok výmeny tepla. Pri absencii výmeny tepla s okolím je chemický reaktor adiabatický. V ňom sa všetko teplo uvoľnené alebo absorbované v dôsledku chemických procesov vynakladá na „vnútornú“ výmenu tepla - zahrievanie alebo chladenie reakčnej zmesi. Reaktor sa nazýva izotermický, ak je v ňom vďaka výmene tepla s okolím zabezpečená stála teplota. V tomto prípade je v ktoromkoľvek bode reaktora uvoľňovanie alebo absorpcia tepla úplne kompenzované výmenou tepla. V reaktoroch so stredným tepelným režimom je tepelný účinok chemickej reakcie čiastočne kompenzovaný výmenou tepla s okolím a čiastočne spôsobuje zmenu teploty reakčnej zmesi. (polytermálny reaktor)
Chemické reaktory 2) Klasifikácia podľa podmienok výmeny tepla. Pri absencii výmeny tepla s okolím je chemický reaktor adiabatický. V ňom sa všetko teplo uvoľnené alebo absorbované v dôsledku chemických procesov vynakladá na „vnútornú“ výmenu tepla - zahrievanie alebo chladenie reakčnej zmesi. Reaktor sa nazýva izotermický, ak je v ňom vďaka výmene tepla s okolím zabezpečená stála teplota. V tomto prípade je v ktoromkoľvek bode reaktora uvoľňovanie alebo absorpcia tepla úplne kompenzované výmenou tepla. V reaktoroch so stredným tepelným režimom je tepelný účinok chemickej reakcie čiastočne kompenzovaný výmenou tepla s okolím a čiastočne spôsobuje zmenu teploty reakčnej zmesi. (polytermálny reaktor)
 Chemické reaktory 3) Klasifikácia podľa fázového zloženia reakčnej zmesi. Na uskutočňovanie homogénnych procesov sa používajú reaktory pre reakcie v plynnej fáze a v kvapalnej fáze, pre heterogénne procesy - reaktory plyn-kvapalina, reaktory pre procesy v systémoch plyn-pevná látka, kvapalina-pevná látka atď. Osobitnú pozornosť treba venovať reaktorom na vykonávanie heterogénnych katalytických procesov. 4) Klasifikácia podľa spôsobu organizácie procesu. Podľa spôsobu organizácie procesu (spôsob dodávania činidiel a odstraňovania produktov) sa reaktory delia na periodické, kontinuálne pracujúce (prietokové) a polokontinuálne (polovsádzkové) 5) Klasifikácia podľa charakteru zmien v procesných parametroch v čase. V závislosti od povahy zmeny parametrov procesu v čase môžu tie isté reaktory pracovať v stacionárnom a nestacionárnom režime.
Chemické reaktory 3) Klasifikácia podľa fázového zloženia reakčnej zmesi. Na uskutočňovanie homogénnych procesov sa používajú reaktory pre reakcie v plynnej fáze a v kvapalnej fáze, pre heterogénne procesy - reaktory plyn-kvapalina, reaktory pre procesy v systémoch plyn-pevná látka, kvapalina-pevná látka atď. Osobitnú pozornosť treba venovať reaktorom na vykonávanie heterogénnych katalytických procesov. 4) Klasifikácia podľa spôsobu organizácie procesu. Podľa spôsobu organizácie procesu (spôsob dodávania činidiel a odstraňovania produktov) sa reaktory delia na periodické, kontinuálne pracujúce (prietokové) a polokontinuálne (polovsádzkové) 5) Klasifikácia podľa charakteru zmien v procesných parametroch v čase. V závislosti od povahy zmeny parametrov procesu v čase môžu tie isté reaktory pracovať v stacionárnom a nestacionárnom režime.
 Chemické reaktory Prevádzkový režim reaktora sa nazýva stacionárny, ak je výskyt chemickej reakcie v ľubovoľne zvolenom bode charakterizovaný rovnakými hodnotami koncentrácií činidiel alebo produktov, teplotou a inými parametrami procesu v akomkoľvek čase. V ustálenom režime parametre prietoku na výstupe z reaktora nezávisia od času. Ak v ľubovoľne zvolenom bode nastanú v priebehu času zmeny parametrov chemického procesu podľa jedného alebo druhého zákona, prevádzkový režim reaktora sa nazýva nestacionárny. Nestabilný režim je všeobecnejší. Stacionárny režim je možný pre nepretržite pracujúce prietokové reaktory. Ale tieto reaktory tiež pracujú v nestabilnom režime v momentoch ich spúšťania a odstavovania. Všetky periodické procesy sú nestacionárne.
Chemické reaktory Prevádzkový režim reaktora sa nazýva stacionárny, ak je výskyt chemickej reakcie v ľubovoľne zvolenom bode charakterizovaný rovnakými hodnotami koncentrácií činidiel alebo produktov, teplotou a inými parametrami procesu v akomkoľvek čase. V ustálenom režime parametre prietoku na výstupe z reaktora nezávisia od času. Ak v ľubovoľne zvolenom bode nastanú v priebehu času zmeny parametrov chemického procesu podľa jedného alebo druhého zákona, prevádzkový režim reaktora sa nazýva nestacionárny. Nestabilný režim je všeobecnejší. Stacionárny režim je možný pre nepretržite pracujúce prietokové reaktory. Ale tieto reaktory tiež pracujú v nestabilnom režime v momentoch ich spúšťania a odstavovania. Všetky periodické procesy sú nestacionárne.
 Chemické reaktory 6) Klasifikácia podľa konštrukčných charakteristík. Chemické reaktory sa od seba líšia množstvom konštrukčných charakteristík, ktoré ovplyvňujú ich konštrukciu a výrobu. Podľa tohto klasifikačného princípu možno rozlíšiť nasledujúce typy reaktorov: kapacitné reaktory (autoklávy; komorové reaktory; vertikálne a horizontálne valcové konvertory atď.); kolónové reaktory (náplňové a doskové kolónové reaktory; katalytické reaktory s pevným, pohyblivým a fluidným lôžkom katalyzátora; regálové reaktory); reaktory typu výmenníka tepla; reaktory, ako sú reakčné pece (šachtové, policové, komorové, rotačné pece atď.)
Chemické reaktory 6) Klasifikácia podľa konštrukčných charakteristík. Chemické reaktory sa od seba líšia množstvom konštrukčných charakteristík, ktoré ovplyvňujú ich konštrukciu a výrobu. Podľa tohto klasifikačného princípu možno rozlíšiť nasledujúce typy reaktorov: kapacitné reaktory (autoklávy; komorové reaktory; vertikálne a horizontálne valcové konvertory atď.); kolónové reaktory (náplňové a doskové kolónové reaktory; katalytické reaktory s pevným, pohyblivým a fluidným lôžkom katalyzátora; regálové reaktory); reaktory typu výmenníka tepla; reaktory, ako sú reakčné pece (šachtové, policové, komorové, rotačné pece atď.)
 Materiálové a tepelné bilancie reaktorov Vytvorme materiálovú bilanciu pre východiskovú látku A pri vykonávaní jednoduchej ireverzibilnej reakcie A → R. Vo všeobecnosti rovnicu materiálovej bilancie zapíšeme ako kde je hmotnostný tok Vzhľadom na to, že látka A vstupujúca do reaktora sa spotrebuje v troch smeroch, môžeme napísať kde - hmotnosť látky A, ktorá vstúpila do chemickej reakcie v reakčnom objeme za jednotku času; – odtok látky A – hmotnosť látky A opúšťajúca reakčný objem za jednotku času; – akumulácia látky A – hmotnosť látky A zostávajúca nezmenená v reakčnom objeme za jednotku času.
Materiálové a tepelné bilancie reaktorov Vytvorme materiálovú bilanciu pre východiskovú látku A pri vykonávaní jednoduchej ireverzibilnej reakcie A → R. Vo všeobecnosti rovnicu materiálovej bilancie zapíšeme ako kde je hmotnostný tok Vzhľadom na to, že látka A vstupujúca do reaktora sa spotrebuje v troch smeroch, môžeme napísať kde - hmotnosť látky A, ktorá vstúpila do chemickej reakcie v reakčnom objeme za jednotku času; – odtok látky A – hmotnosť látky A opúšťajúca reakčný objem za jednotku času; – akumulácia látky A – hmotnosť látky A zostávajúca nezmenená v reakčnom objeme za jednotku času.
 Materiálové a tepelné bilancie reaktorov Rozdiel medzi hmotnosťou látky A vstupujúcej do reaktora za jednotku času a opúšťajúcou reaktor je hmotnosťou látky A transportovanej konvekčným prúdením. Vzhľadom na to možno výslednú rovnicu zapísať v nasledujúcom tvare: V každom konkrétnom prípade má rovnica materiálovej bilancie iný tvar.
Materiálové a tepelné bilancie reaktorov Rozdiel medzi hmotnosťou látky A vstupujúcej do reaktora za jednotku času a opúšťajúcou reaktor je hmotnosťou látky A transportovanej konvekčným prúdením. Vzhľadom na to možno výslednú rovnicu zapísať v nasledujúcom tvare: V každom konkrétnom prípade má rovnica materiálovej bilancie iný tvar.
 Materiálové a tepelné bilancie reaktorov z CA (vo vnútri reaktora) x wx y Základom pre kinetický výpočet reaktora je rovnica okamžitej materiálovej bilancie, nazývaná charakteristická rovnica, získaná pre nekonečne malý objem (elementárneho) reaktora v nekonečne malý čas. V tomto prípade bude materiálová bilancia vyjadrená diferenciálnou rovnicou
Materiálové a tepelné bilancie reaktorov z CA (vo vnútri reaktora) x wx y Základom pre kinetický výpočet reaktora je rovnica okamžitej materiálovej bilancie, nazývaná charakteristická rovnica, získaná pre nekonečne malý objem (elementárneho) reaktora v nekonečne malý čas. V tomto prípade bude materiálová bilancia vyjadrená diferenciálnou rovnicou
 Materiálové a tepelné bilancie reaktorov Výsledkom je rovnica konvekčného prenosu hmoty doplnená o člen r. A, ktorý zohľadňuje výskyt chemickej reakcie. Zostavený z východiskového činidla A má formu, kde CA je koncentrácia látky A v reakčnej zmesi; x, y, z – priestorové súradnice; D – koeficient molekulovej a turbulentnej difúzie; r. A je rýchlosť chemickej reakcie. Pojem na ľavej strane rovnice odráža celkovú zmenu koncentrácie východiskovej látky v čase v elementárnom objeme, pre ktorý sa zostavuje materiálová bilancia. Ide o akumuláciu látky A.
Materiálové a tepelné bilancie reaktorov Výsledkom je rovnica konvekčného prenosu hmoty doplnená o člen r. A, ktorý zohľadňuje výskyt chemickej reakcie. Zostavený z východiskového činidla A má formu, kde CA je koncentrácia látky A v reakčnej zmesi; x, y, z – priestorové súradnice; D – koeficient molekulovej a turbulentnej difúzie; r. A je rýchlosť chemickej reakcie. Pojem na ľavej strane rovnice odráža celkovú zmenu koncentrácie východiskovej látky v čase v elementárnom objeme, pre ktorý sa zostavuje materiálová bilancia. Ide o akumuláciu látky A.
 Materiálové a tepelné bilancie reaktorov, kde: rýchlosť akumulácie koncentrácie vo vnútri elementárneho objemu, konvekčný tok činidla A v elementárnom objeme reaktora, difúzny tok činidla A v elementárnom objeme reaktora. rýchlosť chemickej premeny vo vnútri elementárneho objemu
Materiálové a tepelné bilancie reaktorov, kde: rýchlosť akumulácie koncentrácie vo vnútri elementárneho objemu, konvekčný tok činidla A v elementárnom objeme reaktora, difúzny tok činidla A v elementárnom objeme reaktora. rýchlosť chemickej premeny vo vnútri elementárneho objemu
 Materiálové a tepelné bilancie reaktorov Tepelnú bilanciu vo všeobecnosti možno znázorniť rovnicou Qin = Qexp, kde Qin je množstvo tepla vstupujúceho do reaktora za jednotku času; Qexp je množstvo tepla spotrebovaného za jednotku času. Uvažujme prípad, keď nastane jednoduchá nevratná reakcia A → R s uvoľnením tepla: A → R + Q, potom príchod tepla môžeme zapísať ako Qin = Qx. p + Qreact, kde Qx. p – množstvo tepla uvoľneného v dôsledku chemickej premeny látky A za jednotku času; Qreact je množstvo tepla, ktoré prinesú počiatočné činidlá vstupujúce do reaktora za jednotku času. Spotrebu tepla možno znázorniť rovnicou Qexp = Qprod + Qacc + Qt, kde Qprod je množstvo tepla odvedeného z reaktora reakčnými produktmi za jednotku času; Qacc – množstvo tepla naakumulovaného v reaktore za jednotku času; Qt je množstvo tepla spotrebovaného za jednotku času v dôsledku výmeny tepla s prostredím.
Materiálové a tepelné bilancie reaktorov Tepelnú bilanciu vo všeobecnosti možno znázorniť rovnicou Qin = Qexp, kde Qin je množstvo tepla vstupujúceho do reaktora za jednotku času; Qexp je množstvo tepla spotrebovaného za jednotku času. Uvažujme prípad, keď nastane jednoduchá nevratná reakcia A → R s uvoľnením tepla: A → R + Q, potom príchod tepla môžeme zapísať ako Qin = Qx. p + Qreact, kde Qx. p – množstvo tepla uvoľneného v dôsledku chemickej premeny látky A za jednotku času; Qreact je množstvo tepla, ktoré prinesú počiatočné činidlá vstupujúce do reaktora za jednotku času. Spotrebu tepla možno znázorniť rovnicou Qexp = Qprod + Qacc + Qt, kde Qprod je množstvo tepla odvedeného z reaktora reakčnými produktmi za jednotku času; Qacc – množstvo tepla naakumulovaného v reaktore za jednotku času; Qt je množstvo tepla spotrebovaného za jednotku času v dôsledku výmeny tepla s prostredím.
 Materiálové a tepelné bilancie reaktorov Qx. p + Qreact = Qprod + Qacc + Qt Vo všeobecnosti dochádza k zmene parametrov procesu (teplota, koncentrácia atď.) v priebehu objemu reaktora alebo v čase, a teda tepelnej bilancie, ako aj materiálu. sa tvorí v diferenciálnej forme. Na tento účel sa používa diferenciálna rovnica prenosu tepla konvekciou, do ktorej sa zavádzajú ďalšie pojmy, ktoré zohľadňujú odvod tepla ako výsledok výmeny tepla a reakčné teplo. kde p je hustota reakčnej zmesi; Ср – merná tepelná kapacita reakčnej zmesi; x, y, z – priestorové súradnice; Wx, Wy, Wz – zložky rýchlosti prúdenia v smere osí X, Y, Z; λ – koeficient molekulovej a turbulentnej tepelnej vodivosti reakčnej zmesi; Fsp – merná teplovýmenná plocha; K – súčiniteľ prestupu tepla; ΔT = T – Tt, kde T je teplota reakčnej zmesi; Тт – teplota vo výmenníku tepla; r – rýchlosť chemickej reakcie; ΔН – zmena reakčnej entalpie
Materiálové a tepelné bilancie reaktorov Qx. p + Qreact = Qprod + Qacc + Qt Vo všeobecnosti dochádza k zmene parametrov procesu (teplota, koncentrácia atď.) v priebehu objemu reaktora alebo v čase, a teda tepelnej bilancie, ako aj materiálu. sa tvorí v diferenciálnej forme. Na tento účel sa používa diferenciálna rovnica prenosu tepla konvekciou, do ktorej sa zavádzajú ďalšie pojmy, ktoré zohľadňujú odvod tepla ako výsledok výmeny tepla a reakčné teplo. kde p je hustota reakčnej zmesi; Ср – merná tepelná kapacita reakčnej zmesi; x, y, z – priestorové súradnice; Wx, Wy, Wz – zložky rýchlosti prúdenia v smere osí X, Y, Z; λ – koeficient molekulovej a turbulentnej tepelnej vodivosti reakčnej zmesi; Fsp – merná teplovýmenná plocha; K – súčiniteľ prestupu tepla; ΔT = T – Tt, kde T je teplota reakčnej zmesi; Тт – teplota vo výmenníku tepla; r – rýchlosť chemickej reakcie; ΔН – zmena reakčnej entalpie
 Matematické modely procesov v ideálnych reaktoroch Uvažujme reaktory pracujúce v izotermickom režime. Keďže v takýchto reaktoroch neexistuje hnacia sila výmeny tepla v ich objeme (∆T = 0), rovnicu tepelnej bilancie možno na začiatku vylúčiť z matematického modelu reaktora. V tomto prípade je matematický model redukovaný na rovnicu materiálovej bilancie, ktorá zohľadňuje chemickú reakciu a prenos hmoty. Vsádzkové reaktory sa vyznačujú súčasným plnením činidiel. V tomto prípade proces pozostáva z troch etáp: nakladanie surovín, ich spracovanie (chemická premena) a vykladanie produktu. Po vykonaní týchto operácií sa tieto znova opakujú, t.j. reaktor pracuje cyklicky. Čas jedného cyklu uskutočneného v periodickom reaktore je určený rovnicou = + kde je celkový čas cyklu; – pracovný čas strávený vykonaním chemickej reakcie; – pomocný čas strávený nakladaním činidiel a vykladaním produktu.
Matematické modely procesov v ideálnych reaktoroch Uvažujme reaktory pracujúce v izotermickom režime. Keďže v takýchto reaktoroch neexistuje hnacia sila výmeny tepla v ich objeme (∆T = 0), rovnicu tepelnej bilancie možno na začiatku vylúčiť z matematického modelu reaktora. V tomto prípade je matematický model redukovaný na rovnicu materiálovej bilancie, ktorá zohľadňuje chemickú reakciu a prenos hmoty. Vsádzkové reaktory sa vyznačujú súčasným plnením činidiel. V tomto prípade proces pozostáva z troch etáp: nakladanie surovín, ich spracovanie (chemická premena) a vykladanie produktu. Po vykonaní týchto operácií sa tieto znova opakujú, t.j. reaktor pracuje cyklicky. Čas jedného cyklu uskutočneného v periodickom reaktore je určený rovnicou = + kde je celkový čas cyklu; – pracovný čas strávený vykonaním chemickej reakcie; – pomocný čas strávený nakladaním činidiel a vykladaním produktu.
 Matematické modely procesov v ideálnych reaktoroch Periodický ideálny zmiešavací reaktor (RIS-P) CA 0 CA CA = 0 CA 1 = Rozloženie koncentrácie činidla A v RIS-P: a – v čase; b – objemovo: CA 0, CA 1 – koncentrácia činidla A v reakčnej zmesi na začiatku a na konci procesu; – čas Periodické procesy sú svojou povahou vždy nestacionárne, pretože v nich sa v dôsledku chemickej reakcie v priebehu času menia parametre procesu, napríklad koncentrácia látok zúčastňujúcich sa reakcie, t. j. akumulácia látky.
Matematické modely procesov v ideálnych reaktoroch Periodický ideálny zmiešavací reaktor (RIS-P) CA 0 CA CA = 0 CA 1 = Rozloženie koncentrácie činidla A v RIS-P: a – v čase; b – objemovo: CA 0, CA 1 – koncentrácia činidla A v reakčnej zmesi na začiatku a na konci procesu; – čas Periodické procesy sú svojou povahou vždy nestacionárne, pretože v nich sa v dôsledku chemickej reakcie v priebehu času menia parametre procesu, napríklad koncentrácia látok zúčastňujúcich sa reakcie, t. j. akumulácia látky.
 Periodický ideálny zmiešavací reaktor (RIS-P) (7 1) S prihliadnutím na získané hodnoty je rovnica (7 1) zjednodušená a možno ju zapísať nie parciálnymi deriváciami, ale vo forme obyčajnej diferenciálnej rovnice: (7 2)
Periodický ideálny zmiešavací reaktor (RIS-P) (7 1) S prihliadnutím na získané hodnoty je rovnica (7 1) zjednodušená a možno ju zapísať nie parciálnymi deriváciami, ale vo forme obyčajnej diferenciálnej rovnice: (7 2)
 Periodický ideálny zmiešavací reaktor (RIS-P) Všetky reakcie prebiehajú buď bez zmeny, alebo so zmenou objemu reakčnej zmesi. Pre reakcie prvého typu (V = const) je aktuálna koncentrácia činidla A kde NA je počiatočné chemické množstvo východiskovej látky A v reakčnej zmesi; V je objem reakčnej zmesi. Dosadením výsledného výrazu pre SA do rovnice (7 2) nájdeme alebo (7 3)
Periodický ideálny zmiešavací reaktor (RIS-P) Všetky reakcie prebiehajú buď bez zmeny, alebo so zmenou objemu reakčnej zmesi. Pre reakcie prvého typu (V = const) je aktuálna koncentrácia činidla A kde NA je počiatočné chemické množstvo východiskovej látky A v reakčnej zmesi; V je objem reakčnej zmesi. Dosadením výsledného výrazu pre SA do rovnice (7 2) nájdeme alebo (7 3)
 Periodický ideálny zmiešavací reaktor (RIS-P) Integračná rovnica (7 3) v medziach časovej zmeny z 0 na a stupňa konverzie z 0 na x. A získame charakteristickú rovnicu RIS-P pre podmienky, keď sa objem reakčnej zmesi počas procesu nemení: (7 4) Uvažujme niektoré špeciálne prípady tejto rovnice Pre ireverzibilnú reakciu nultého rádu Pre ireverzibilnú reakciu prvá objednávka
Periodický ideálny zmiešavací reaktor (RIS-P) Integračná rovnica (7 3) v medziach časovej zmeny z 0 na a stupňa konverzie z 0 na x. A získame charakteristickú rovnicu RIS-P pre podmienky, keď sa objem reakčnej zmesi počas procesu nemení: (7 4) Uvažujme niektoré špeciálne prípady tejto rovnice Pre ireverzibilnú reakciu nultého rádu Pre ireverzibilnú reakciu prvá objednávka
 Reaktor s periodickým ideálnym miešaním (RIS-P) Pre ireverzibilnú reakciu n-tého rádu V prípadoch, keď je integrácia rovnice (7 4) spojená s ťažkosťami, sa určenie času vykonáva metódou grafickej integrácie. Na tento účel nakreslite grafickú závislosť 1/(– r. A) od x. A a vypočítajte plochu pod krivkou medzi počiatočným x. A 0 a koncové x. A hodnoty stupňa transformácie. Pre x. A 0 = 0 požadovaná plocha je vyjadrená rovnicou Dosadením získanej hodnoty pre S do rovnice (7 4) zistíme
Reaktor s periodickým ideálnym miešaním (RIS-P) Pre ireverzibilnú reakciu n-tého rádu V prípadoch, keď je integrácia rovnice (7 4) spojená s ťažkosťami, sa určenie času vykonáva metódou grafickej integrácie. Na tento účel nakreslite grafickú závislosť 1/(– r. A) od x. A a vypočítajte plochu pod krivkou medzi počiatočným x. A 0 a koncové x. A hodnoty stupňa transformácie. Pre x. A 0 = 0 požadovaná plocha je vyjadrená rovnicou Dosadením získanej hodnoty pre S do rovnice (7 4) zistíme

 Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Pre kontinuálne reaktory je vhodnejšie použiť koncepciu podmienenej doby zotrvania činidiel v systéme (kontaktnej doby), ktorá je určená rovnicou = kde je čas pobytu; Vр – objem reaktora; Vo je objem reakčnej zmesi vstupujúcej do reaktora za jednotku času (objemový prietok činidiel), meraný za určitých podmienok. Prietokové reaktory sa líšia odlišným charakterom pohybu látok v nich (hydrodynamické podmienky). Na tomto základe sa kontinuálne reaktory delia na: ü reaktory s piestovým tokom (PPR) ü ideálne zmiešavacie reaktory (IMR).
Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Pre kontinuálne reaktory je vhodnejšie použiť koncepciu podmienenej doby zotrvania činidiel v systéme (kontaktnej doby), ktorá je určená rovnicou = kde je čas pobytu; Vр – objem reaktora; Vo je objem reakčnej zmesi vstupujúcej do reaktora za jednotku času (objemový prietok činidiel), meraný za určitých podmienok. Prietokové reaktory sa líšia odlišným charakterom pohybu látok v nich (hydrodynamické podmienky). Na tomto základe sa kontinuálne reaktory delia na: ü reaktory s piestovým tokom (PPR) ü ideálne zmiešavacie reaktory (IMR).
 Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PPR) Reaktor s piestovým tokom je rúrkový reaktor s pomerom dĺžky rúrky L k jej priemeru d väčším ako 20, do ktorého sa privádzajú počiatočné činidlá, ktoré sa premieňajú na reakčné produkty. d, keď sa pohybujú po dĺžke reaktora. V CA 0, x. A CA Zmena koncentrácie a stupňa premeny činidla A pozdĺž dĺžky reaktora L CA 0 CA x. A l L x. A 0 0 L l
Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PPR) Reaktor s piestovým tokom je rúrkový reaktor s pomerom dĺžky rúrky L k jej priemeru d väčším ako 20, do ktorého sa privádzajú počiatočné činidlá, ktoré sa premieňajú na reakčné produkty. d, keď sa pohybujú po dĺžke reaktora. V CA 0, x. A CA Zmena koncentrácie a stupňa premeny činidla A pozdĺž dĺžky reaktora L CA 0 CA x. A l L x. A 0 0 L l
 Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Keďže v PPR sa reakčná zmes pohybuje len jedným smerom (po dĺžke l), tak pre prvú skupinu členov na pravej strane rovnice (7 1) môžeme napíšte (voľbou smeru osi X ako pohybu toku činidiel v reaktore): kde W je lineárna rýchlosť pohybu reakčnej zmesi v reaktore; l je dĺžka dráhy, ktorú prejde prvok objemu reakčnej zmesi v reaktore. Takže každý prvok objemu reakčnej zmesi v reaktore sa nezmieša ani s predchádzajúcimi, ani s nasledujúcimi objemami a nedochádza ani k radiálnemu miešaniu (t. j. nedochádza ani k pozdĺžnej, ani k radiálnej difúzii).
Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Keďže v PPR sa reakčná zmes pohybuje len jedným smerom (po dĺžke l), tak pre prvú skupinu členov na pravej strane rovnice (7 1) môžeme napíšte (voľbou smeru osi X ako pohybu toku činidiel v reaktore): kde W je lineárna rýchlosť pohybu reakčnej zmesi v reaktore; l je dĺžka dráhy, ktorú prejde prvok objemu reakčnej zmesi v reaktore. Takže každý prvok objemu reakčnej zmesi v reaktore sa nezmieša ani s predchádzajúcimi, ani s nasledujúcimi objemami a nedochádza ani k radiálnemu miešaniu (t. j. nedochádza ani k pozdĺžnej, ani k radiálnej difúzii).
 Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PWR) Berúc do úvahy vyššie uvedené, rovnica (7 1) pre reaktory s piestovým tokom má tvar (7 5) Táto rovnica materiálovej bilancie je matematickým popisom toku činidiel v PRI v nestabilnom režime (ako keď sa parametre procesov menia nielen po dĺžke reaktora, ale nie sú ani v čase konštantné) Stacionárny režim je charakteristický tým, že parametre v danom bode reakčného objemu sa menia nemení v čase, t.j. potom rovnica (7 5) bude mať tvar (7 6)
Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PWR) Berúc do úvahy vyššie uvedené, rovnica (7 1) pre reaktory s piestovým tokom má tvar (7 5) Táto rovnica materiálovej bilancie je matematickým popisom toku činidiel v PRI v nestabilnom režime (ako keď sa parametre procesov menia nielen po dĺžke reaktora, ale nie sú ani v čase konštantné) Stacionárny režim je charakteristický tým, že parametre v danom bode reakčného objemu sa menia nemení v čase, t.j. potom rovnica (7 5) bude mať tvar (7 6)
 Ak sa objem reakčnej zmesi počas procesu nemení, potom platí rovnica po diferenciácii, ktorú získame: Dĺžka dráhy l môže byť vyjadrená ako súčin (W), odkiaľ pri konštantnom lineárnom prietoku dl = W d (7 7) Po integrácii rovnice (7 7) v rámci zmien v stupni konverzie z 0 na x. A dostaneme charakteristickú rovnicu RIV: (7 8)
Ak sa objem reakčnej zmesi počas procesu nemení, potom platí rovnica po diferenciácii, ktorú získame: Dĺžka dráhy l môže byť vyjadrená ako súčin (W), odkiaľ pri konštantnom lineárnom prietoku dl = W d (7 7) Po integrácii rovnice (7 7) v rámci zmien v stupni konverzie z 0 na x. A dostaneme charakteristickú rovnicu RIV: (7 8)
 Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Rovnica (7 8) pre PRI je podobná rovnici (7 4) získanej pre RIS P. V rovnici (7 4) čas je reakčný čas vo vsádzkovom reaktore (od nakladanie surovín pred vyložením produktov), a v rovnici (7 8) - čas, za ktorý reakčná zmes prechádza cez RIV od vstupu do reaktora po výstup z neho (za predpokladu, že reakcia prebieha bez zmeny objem). Rovnica (7 8) pre ireverzibilnú reakciu n-tého rádu bude mať tvar: alebo Pre reakciu nultého rádu má vzorec tvar Pre ireverzibilnú reakciu prvého rádu.
Kontinuálne reaktory (prietokové reaktory) Plug-fill reaktor (PPR) Rovnica (7 8) pre PRI je podobná rovnici (7 4) získanej pre RIS P. V rovnici (7 4) čas je reakčný čas vo vsádzkovom reaktore (od nakladanie surovín pred vyložením produktov), a v rovnici (7 8) - čas, za ktorý reakčná zmes prechádza cez RIV od vstupu do reaktora po výstup z neho (za predpokladu, že reakcia prebieha bez zmeny objem). Rovnica (7 8) pre ireverzibilnú reakciu n-tého rádu bude mať tvar: alebo Pre reakciu nultého rádu má vzorec tvar Pre ireverzibilnú reakciu prvého rádu.
 Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PPR) Pre reakcie vyššieho rádu je vhodné použiť metódu grafickej integrácie na určenie doby zotrvania. Na tento účel vytvorte grafickú závislosť 1 / (– r. A) na x. A a vypočítajte plochu pod krivkou Svyt medzi počiatočnou a konečnou hodnotou stupňa konverzie x. A 0 a x. A: 0 x. A
Kontinuálne reaktory (prietokové reaktory) Reaktor s piestovým tokom (PPR) Pre reakcie vyššieho rádu je vhodné použiť metódu grafickej integrácie na určenie doby zotrvania. Na tento účel vytvorte grafickú závislosť 1 / (– r. A) na x. A a vypočítajte plochu pod krivkou Svyt medzi počiatočnou a konečnou hodnotou stupňa konverzie x. A 0 a x. A: 0 x. A
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny miešací reaktor (RIS-N) CA 0 CA Kontinuálny ideálny miešací reaktor (RIS-N) je reaktor s miešadlom, do ktorého sa kontinuálne privádzajú reagencie a odoberajú sa z neho reakčné produkty. Vďaka intenzívnemu miešaniu prúdov sa koncentrácia činidla A okamžite nastaví v celom objeme reaktora, rovná jeho koncentrácii na výstupe z reaktora. Prudká zmena koncentrácie pri vstupe činidiel do reaktora nastáva v dôsledku okamžitého zmiešania vstupujúcich činidiel s reakčnou hmotou už v reaktore, kde je koncentrácia zložky A výrazne nižšia ako v privádzanej reakčnej zmesi.
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny miešací reaktor (RIS-N) CA 0 CA Kontinuálny ideálny miešací reaktor (RIS-N) je reaktor s miešadlom, do ktorého sa kontinuálne privádzajú reagencie a odoberajú sa z neho reakčné produkty. Vďaka intenzívnemu miešaniu prúdov sa koncentrácia činidla A okamžite nastaví v celom objeme reaktora, rovná jeho koncentrácii na výstupe z reaktora. Prudká zmena koncentrácie pri vstupe činidiel do reaktora nastáva v dôsledku okamžitého zmiešania vstupujúcich činidiel s reakčnou hmotou už v reaktore, kde je koncentrácia zložky A výrazne nižšia ako v privádzanej reakčnej zmesi.
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) CA 0 CA Veľkosť rozdielu medzi počiatočnou CA 0 a konečnou koncentráciou CA počiatočného činidla závisí, pričom ostatné veci sú rovnaké, od rýchlosti chemickej reakcie . Čím je vyššia, tým nižšia je koncentrácia činidla A v reaktore a tým väčší je rozdiel (CA 0 - CA). Na druhej strane pri rovnakej reakčnej rýchlosti závisí veľkosť rozdielu od doby zotrvania () reaktantov v reaktore. Čím je vyššia, tým je reakcia kompletnejšia a tým nižšia je koncentrácia SA činidla v reakčnej zmesi. CA 0 CA 1 CA 2 CA Koncentrácia činidla A v RIS N pri rôznych časoch zotrvania činidiel v reaktore (1
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) CA 0 CA Veľkosť rozdielu medzi počiatočnou CA 0 a konečnou koncentráciou CA počiatočného činidla závisí, pričom ostatné veci sú rovnaké, od rýchlosti chemickej reakcie . Čím je vyššia, tým nižšia je koncentrácia činidla A v reaktore a tým väčší je rozdiel (CA 0 - CA). Na druhej strane pri rovnakej reakčnej rýchlosti závisí veľkosť rozdielu od doby zotrvania () reaktantov v reaktore. Čím je vyššia, tým je reakcia kompletnejšia a tým nižšia je koncentrácia SA činidla v reakčnej zmesi. CA 0 CA 1 CA 2 CA Koncentrácia činidla A v RIS N pri rôznych časoch zotrvania činidiel v reaktore (1
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) –r. A XA –r. A 0 XАк –r. Ak XA 0 V 0 a) V V b) Zmena parametrov na OBRÁZKU-N: a – stupeň premeny x. A; b – rýchlosť procesu r. A
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) –r. A XA –r. A 0 XАк –r. Ak XA 0 V 0 a) V V b) Zmena parametrov na OBRÁZKU-N: a – stupeň premeny x. A; b – rýchlosť procesu r. A
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Na základe rovnice materiálovej bilancie: CA 0 CA kde Vр – objem reaktora; V – objemový prietok činidiel
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Na základe rovnice materiálovej bilancie: CA 0 CA kde Vр – objem reaktora; V – objemový prietok činidiel
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Podmienkou stacionárnosti procesu v RIS-N je rovnosť rýchlosti konvekčného prenosu látky A a rýchlosti jej chemickej premeny CA 0 CA kde Vр je objem reaktora; V – objemový prietok činidiel Pomer Vp / V je podmienený čas zdržania. Potom (7 9) Toto je charakteristická rovnica ideálneho zmiešavacieho reaktora. Pre všeobecnejší prípad, keď počiatočný stupeň transformácie je x. A 0 sa nerovná nule, píše sa
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Podmienkou stacionárnosti procesu v RIS-N je rovnosť rýchlosti konvekčného prenosu látky A a rýchlosti jej chemickej premeny CA 0 CA kde Vр je objem reaktora; V – objemový prietok činidiel Pomer Vp / V je podmienený čas zdržania. Potom (7 9) Toto je charakteristická rovnica ideálneho zmiešavacieho reaktora. Pre všeobecnejší prípad, keď počiatočný stupeň transformácie je x. A 0 sa nerovná nule, píše sa
 Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Pre jednoduchú ireverzibilnú reakciu n-tého rádu bude mať rovnica (7 9) tvar CA 0 CA Pre reakciu nultého rádu Pre reakciu prvého rádu
Kontinuálne reaktory (prietokové reaktory) Kontinuálny ideálny zmiešavací reaktor (RIS-N) Pre jednoduchú ireverzibilnú reakciu n-tého rádu bude mať rovnica (7 9) tvar CA 0 CA Pre reakciu nultého rádu Pre reakciu prvého rádu
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych miešacích reaktorov (K-RIS) Kaskáda pozostáva z niekoľkých sériovo zapojených prietokových reaktorov (sekcií) ideálneho miešania. Reakčná zmes postupne prechádza všetkými sekciami. CA 0 V poslednom reaktore kaskády sú koncentrácie, a teda aj reakčná rýchlosť rovnaké ako v jednom reaktore, ale v každom z predchádzajúcich zariadení kaskády sú koncentrácie reaktantov vyššie, preto reakcia prebieha sadzby budú vyššie ako v nasledujúcom zariadení. V dôsledku toho priemerná rýchlosť reakcie v kaskáde prekročí priemernú rýchlosť reakcie v jednom reaktore CA 1 CA 2 CA 3
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych miešacích reaktorov (K-RIS) Kaskáda pozostáva z niekoľkých sériovo zapojených prietokových reaktorov (sekcií) ideálneho miešania. Reakčná zmes postupne prechádza všetkými sekciami. CA 0 V poslednom reaktore kaskády sú koncentrácie, a teda aj reakčná rýchlosť rovnaké ako v jednom reaktore, ale v každom z predchádzajúcich zariadení kaskády sú koncentrácie reaktantov vyššie, preto reakcia prebieha sadzby budú vyššie ako v nasledujúcom zariadení. V dôsledku toho priemerná rýchlosť reakcie v kaskáde prekročí priemernú rýchlosť reakcie v jednom reaktore CA 1 CA 2 CA 3
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) CA Úlohou výpočtu kaskády reaktorov je určiť počet stupňov (počet reaktorov) N potrebných na dosiahnutie daného stupňa konverzie x. A. CA 0 CA 1 CA 2 CA 3 1 2 3 N Zmena koncentrácie činidla A v kaskáde ideálnych miešacích reaktorov
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) CA Úlohou výpočtu kaskády reaktorov je určiť počet stupňov (počet reaktorov) N potrebných na dosiahnutie daného stupňa konverzie x. A. CA 0 CA 1 CA 2 CA 3 1 2 3 N Zmena koncentrácie činidla A v kaskáde ideálnych miešacích reaktorov
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych miešacích reaktorov (K-RIS) Na výpočet kaskády reaktorov existujú analytické a grafické metódy Pre výpočet kaskády reaktorov je potrebné mať informácie o kinetike procesu, napr. poznať koncentráciu počiatočného činidla A na vstupe do prvého reaktora CA 0 a na výstupe z posledného reaktora CAN (t.j. celkový stupeň konverzie x. A), je potrebné nastaviť aj objem jednotky čas zdržania v jednotkovom zmiešavacom reaktore τcm) a predpokladá sa, že objemy jednotlivých reaktorov v kaskáde sú rovnaké. Pre jeden N-tý ideálny zmiešavací reaktor (7 10), kde sú koncentrácie zložky A na vstupe do N-tého reaktora a na výstupe z neho. Na výpočet rýchlosti procesu v reaktore uvádzame rovnicu 7 10 v nasledujúcom tvare: (7 11)
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych miešacích reaktorov (K-RIS) Na výpočet kaskády reaktorov existujú analytické a grafické metódy Pre výpočet kaskády reaktorov je potrebné mať informácie o kinetike procesu, napr. poznať koncentráciu počiatočného činidla A na vstupe do prvého reaktora CA 0 a na výstupe z posledného reaktora CAN (t.j. celkový stupeň konverzie x. A), je potrebné nastaviť aj objem jednotky čas zdržania v jednotkovom zmiešavacom reaktore τcm) a predpokladá sa, že objemy jednotlivých reaktorov v kaskáde sú rovnaké. Pre jeden N-tý ideálny zmiešavací reaktor (7 10), kde sú koncentrácie zložky A na vstupe do N-tého reaktora a na výstupe z neho. Na výpočet rýchlosti procesu v reaktore uvádzame rovnicu 7 10 v nasledujúcom tvare: (7 11)
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Z rovnice (7 11) vyplýva, že rýchlosť reakcie r. A lineárne závisí len od koncentrácie na výstupe. Ak je táto závislosť vyjadrená graficky, potom priamka opísaná rovnicou (7 11) pretína os x v bode a má uhol sklonu α rovný – 1 / τcm. Na zistenie koncentrácie v N-tom reaktore je potrebné vyriešiť rovnicu (7-11) spolu s kinetickou rovnicou r. A = f (CA) M na stanovenie koncentrácie činidla na výstupe z prvého CA CA reaktora CA 1 je potrebné z bodu CA 0 ležiaceho na osi x. Grafickou metódou na výpočet kaskády je zakreslenie priamka s dotyčnicou uhla sklonu reaktora - 1 / τcm, kým sa nepretne s krivkou r. A = f(CA) v bode M.
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Z rovnice (7 11) vyplýva, že rýchlosť reakcie r. A lineárne závisí len od koncentrácie na výstupe. Ak je táto závislosť vyjadrená graficky, potom priamka opísaná rovnicou (7 11) pretína os x v bode a má uhol sklonu α rovný – 1 / τcm. Na zistenie koncentrácie v N-tom reaktore je potrebné vyriešiť rovnicu (7-11) spolu s kinetickou rovnicou r. A = f (CA) M na stanovenie koncentrácie činidla na výstupe z prvého CA CA reaktora CA 1 je potrebné z bodu CA 0 ležiaceho na osi x. Grafickou metódou na výpočet kaskády je zakreslenie priamka s dotyčnicou uhla sklonu reaktora - 1 / τcm, kým sa nepretne s krivkou r. A = f(CA) v bode M.
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Pri analytickom výpočte kaskády pre každý stupeň sa používa rovnica materiálovej bilancie jedného kontinuálneho zmiešavacieho reaktora. Použitím charakteristickej rovnice pre RIS N vo forme postupného výpočtu jednotlivých stupňov kaskády získame: ... kde je priemerný čas zotrvania činidiel v jednotlivých stupňoch kaskády ...
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Pri analytickom výpočte kaskády pre každý stupeň sa používa rovnica materiálovej bilancie jedného kontinuálneho zmiešavacieho reaktora. Použitím charakteristickej rovnice pre RIS N vo forme postupného výpočtu jednotlivých stupňov kaskády získame: ... kde je priemerný čas zotrvania činidiel v jednotlivých stupňoch kaskády ...
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Pre reakciu prvého poriadku (n=1) Vp=konšt; V=konst Priemerný čas zdržania reaktantov v kaskáde sa rovná súčtu zdržania v jednotlivých stupňoch, ktorý je rovnaký vo všetkých reaktoroch.
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Pre reakciu prvého poriadku (n=1) Vp=konšt; V=konst Priemerný čas zdržania reaktantov v kaskáde sa rovná súčtu zdržania v jednotlivých stupňoch, ktorý je rovnaký vo všetkých reaktoroch.
 Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Počet reaktorov v kaskáde sa vypočíta pomocou rovnice
Kontinuálne reaktory (prietokové reaktory) Kaskáda ideálnych zmiešavacích reaktorov (K-RIS) Počet reaktorov v kaskáde sa vypočíta pomocou rovnice
 Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom CA CA 0 2 1 CA 1 0 L l Za rovnakých podmienok na uskutočnenie rovnakej reakcie na dosiahnutie rovnakej hĺbky konverzie sa priemerný čas zotrvania reaktantov v prúde reaktor s ideálnym miešaním (1) je väčší ako v reaktore ideálny objem (2).
Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom CA CA 0 2 1 CA 1 0 L l Za rovnakých podmienok na uskutočnenie rovnakej reakcie na dosiahnutie rovnakej hĺbky konverzie sa priemerný čas zotrvania reaktantov v prúde reaktor s ideálnym miešaním (1) je väčší ako v reaktore ideálny objem (2).
 Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom Keďže súčasná koncentrácia v RIV je vyššia, vyplýva z toho, že rýchlosť konverzie je vyššia, takže je potrebný kratší čas CA CA 0 1 2 CA 1 0 L l Na základe toho , veľkosť reaktora je menšia, preto má RIV vyššiu intenzitu ako RIS-N. Pre reakciu prvého rádu n = 1: X = 10 % a = 1,06 X = 58 % a = 1,44 X = 90 % a = 3,9 Preto by objem reaktora RIS-N mal byť 4-krát väčší ako RIV
Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom Keďže súčasná koncentrácia v RIV je vyššia, vyplýva z toho, že rýchlosť konverzie je vyššia, takže je potrebný kratší čas CA CA 0 1 2 CA 1 0 L l Na základe toho , veľkosť reaktora je menšia, preto má RIV vyššiu intenzitu ako RIS-N. Pre reakciu prvého rádu n = 1: X = 10 % a = 1,06 X = 58 % a = 1,44 X = 90 % a = 3,9 Preto by objem reaktora RIS-N mal byť 4-krát väčší ako RIV
 Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom 1 / ra CA 1 CA 0 CA Plochy krivočiarych lichobežníkov zodpovedajúce priemernej dobe zotrvania v RMS sú menšie ako plochy obdĺžnikov zodpovedajúce dobe zdržania v RMS. a rozdiel je väčší, čím väčší je stupeň konverzie východiskového materiálu dosiahnutý v reakčnom činidle. Preto pri rovnakom objemovom prietoku, aby sa dosiahli rovnaké výsledky, musí mať RIV menší objem ako RIS-N.
Porovnanie účinnosti prietokových reaktorov s ideálnym miešaním a ideálnym výtlakom 1 / ra CA 1 CA 0 CA Plochy krivočiarych lichobežníkov zodpovedajúce priemernej dobe zotrvania v RMS sú menšie ako plochy obdĺžnikov zodpovedajúce dobe zdržania v RMS. a rozdiel je väčší, čím väčší je stupeň konverzie východiskového materiálu dosiahnutý v reakčnom činidle. Preto pri rovnakom objemovom prietoku, aby sa dosiahli rovnaké výsledky, musí mať RIV menší objem ako RIS-N.
 Porovnanie selektivity prietokových reaktorov Vzťah k 1, n 1 A φ R k 2, n 2 S V tomto prípade bude rozdielna selektivita závisieť od rozdielu v poradí cieľových a vedľajších reakcií. n 1>n 2 RIV OBRÁZOK CA 1 CA 0 CA Ak n 1>n 2, potom hodnota diferenciálnej selektivity rastie so zvyšujúcou sa koncentráciou činidla CA. V tomto prípade na dosiahnutie vysokej selektivity môžete použiť RIV, pretože v ňom je aktuálna koncentrácia vyššia a môžete použiť aj kaskádu reaktorov.
Porovnanie selektivity prietokových reaktorov Vzťah k 1, n 1 A φ R k 2, n 2 S V tomto prípade bude rozdielna selektivita závisieť od rozdielu v poradí cieľových a vedľajších reakcií. n 1>n 2 RIV OBRÁZOK CA 1 CA 0 CA Ak n 1>n 2, potom hodnota diferenciálnej selektivity rastie so zvyšujúcou sa koncentráciou činidla CA. V tomto prípade na dosiahnutie vysokej selektivity môžete použiť RIV, pretože v ňom je aktuálna koncentrácia vyššia a môžete použiť aj kaskádu reaktorov.
 Porovnanie selektivity prietokových reaktorov φ φ n 1
Porovnanie selektivity prietokových reaktorov φ φ n 1
 Teplotné prevádzkové podmienky reaktorov V závislosti od tepelného režimu sa reaktory delia do troch skupín: adiabatické, izotermické a polytermické Adiabatické a izotermické reaktory predstavujú extrémne prípady, ktoré sa v praxi nestávajú, no prevádzkový režim mnohých priemyselných reaktorov sa týmto extrémnym modelom približuje. , teda s dostatočným Pre praktické účely je možné reaktory presne vypočítať pomocou rovníc získaných pre adiabatické a izotermické režimy. Východiskovou rovnicou pre výpočet reaktorov s prihliadnutím na prenos tepla je rovnica tepelnej bilancie, ktorá sa zvyčajne zostavuje pre jednu zo zložiek reakčnej zmesi. Podobu rovnice tepelnej bilancie určuje aj tepelný režim v reaktore Qx. p + Qreact = Qprod + Qnak + Qt
Teplotné prevádzkové podmienky reaktorov V závislosti od tepelného režimu sa reaktory delia do troch skupín: adiabatické, izotermické a polytermické Adiabatické a izotermické reaktory predstavujú extrémne prípady, ktoré sa v praxi nestávajú, no prevádzkový režim mnohých priemyselných reaktorov sa týmto extrémnym modelom približuje. , teda s dostatočným Pre praktické účely je možné reaktory presne vypočítať pomocou rovníc získaných pre adiabatické a izotermické režimy. Východiskovou rovnicou pre výpočet reaktorov s prihliadnutím na prenos tepla je rovnica tepelnej bilancie, ktorá sa zvyčajne zostavuje pre jednu zo zložiek reakčnej zmesi. Podobu rovnice tepelnej bilancie určuje aj tepelný režim v reaktore Qx. p + Qreact = Qprod + Qnak + Qt
 Teplotné prevádzkové podmienky reaktorov Adiabatický režim V adiabatických reaktoroch nedochádza k výmene tepla s okolím (Qt = 0), pre stacionárne podmienky nedochádza ani k akumulácii tepla (Qacc = 0), preto rovnica tepelnej bilancie nadobúda tvar Qx. р + Qreact = Qprod Dna. Cp. Tn ± Dna. CAx. Aq = Gcont. Cp. Tk
Teplotné prevádzkové podmienky reaktorov Adiabatický režim V adiabatických reaktoroch nedochádza k výmene tepla s okolím (Qt = 0), pre stacionárne podmienky nedochádza ani k akumulácii tepla (Qacc = 0), preto rovnica tepelnej bilancie nadobúda tvar Qx. р + Qreact = Qprod Dna. Cp. Tn ± Dna. CAx. Aq = Gcont. Cp. Tk
Šírka:="" auto="">
 Teplotné prevádzkové podmienky reaktorov Adiabatický režim V stacionárnom režime sú rýchlosť uvoľňovania tepla v dôsledku chemickej premeny () a rýchlosť tepelných strát s konvekčným prúdením rovnaké, čo zaisťuje, že teplota zostáva konštantná v priebehu času pre akýkoľvek bod reaktor. K zmene teploty dochádza len po dĺžke reaktora l. Na získanie celkových tepelných tokov sa integrujú diferenciálne rovnice buď v čase (pre RIS P) alebo cez objem alebo dĺžku (pre RIV). Kontinuálne ideálne zmiešavacie reaktory (IMR) v stacionárnom režime sa vyznačujú absenciou gradientu parametrov v čase aj v objeme, a preto rovnica tepelnej bilancie (ako aj materiálovej bilancie) je zostavená okamžite pre celý reaktor ako celok, s použitím konečných hodnôt parametrov na vstupe do reaktora a na výstupe z neho.
Teplotné prevádzkové podmienky reaktorov Adiabatický režim V stacionárnom režime sú rýchlosť uvoľňovania tepla v dôsledku chemickej premeny () a rýchlosť tepelných strát s konvekčným prúdením rovnaké, čo zaisťuje, že teplota zostáva konštantná v priebehu času pre akýkoľvek bod reaktor. K zmene teploty dochádza len po dĺžke reaktora l. Na získanie celkových tepelných tokov sa integrujú diferenciálne rovnice buď v čase (pre RIS P) alebo cez objem alebo dĺžku (pre RIV). Kontinuálne ideálne zmiešavacie reaktory (IMR) v stacionárnom režime sa vyznačujú absenciou gradientu parametrov v čase aj v objeme, a preto rovnica tepelnej bilancie (ako aj materiálovej bilancie) je zostavená okamžite pre celý reaktor ako celok, s použitím konečných hodnôt parametrov na vstupe do reaktora a na výstupe z neho.
 Teplotné prevádzkové podmienky reaktorov Adiabatický režim v RIS N vďaka intenzívnemu miešaniu všetkých parametrov procesu s hodnotami CA 0, x na vstupe do reaktora. A 0, T 0, okamžite zmeniť na CA, x. A, T, ktoré majú rovnaké hodnoty v celom objeme reaktora a líšia sa od výstupných parametrov (7 12) Rovnica tepelnej bilancie (7 12) ukazuje, že v adiabatickom ideálnom zmiešavacom reaktore kontinuálneho pôsobenia je všetko teplo chemickej reakcie sa vynakladá na zahrievanie reakčných činidiel z teploty To na T a je odvádzané preč z reaktora konvekčným prúdením. Pre akýkoľvek stupeň transformácie x. Látka A, teplota v reaktore sa môže vypočítať pomocou vzorca
Teplotné prevádzkové podmienky reaktorov Adiabatický režim v RIS N vďaka intenzívnemu miešaniu všetkých parametrov procesu s hodnotami CA 0, x na vstupe do reaktora. A 0, T 0, okamžite zmeniť na CA, x. A, T, ktoré majú rovnaké hodnoty v celom objeme reaktora a líšia sa od výstupných parametrov (7 12) Rovnica tepelnej bilancie (7 12) ukazuje, že v adiabatickom ideálnom zmiešavacom reaktore kontinuálneho pôsobenia je všetko teplo chemickej reakcie sa vynakladá na zahrievanie reakčných činidiel z teploty To na T a je odvádzané preč z reaktora konvekčným prúdením. Pre akýkoľvek stupeň transformácie x. Látka A, teplota v reaktore sa môže vypočítať pomocou vzorca
 Teplotné prevádzkové podmienky reaktorov Izotermický režim V izotermickom kontinuálnom ideálnom miešacom reaktore sa teplo odoberá (alebo dodáva) cez stenu, ktorá je chladená nejakým druhom chladiva alebo pomocou teplovýmenných prvkov umiestnených vo vnútri reaktora. Pretože za izotermických podmienok sa teplota reakčného média nemení (T = const) Qx. р + Qreact = Qprod ± Q Dna. Cp. Tn ± Dna. CA 0 x. Aq = Gcont. Cp. Tk ±KFΔT
Teplotné prevádzkové podmienky reaktorov Izotermický režim V izotermickom kontinuálnom ideálnom miešacom reaktore sa teplo odoberá (alebo dodáva) cez stenu, ktorá je chladená nejakým druhom chladiva alebo pomocou teplovýmenných prvkov umiestnených vo vnútri reaktora. Pretože za izotermických podmienok sa teplota reakčného média nemení (T = const) Qx. р + Qreact = Qprod ± Q Dna. Cp. Tn ± Dna. CA 0 x. Aq = Gcont. Cp. Tk ±KFΔT
Šírka:="" auto="">
Šírka:="" auto="">
 Teplotné prevádzkové podmienky reaktorov Rovnica tepelnej bilancie polytermického režimu pre polytermálne RIS-N N x. A = Porovnanie reaktorov podľa teplotného režimu (exotermická reakcia) x ΔH
Teplotné prevádzkové podmienky reaktorov Rovnica tepelnej bilancie polytermického režimu pre polytermálne RIS-N N x. A = Porovnanie reaktorov podľa teplotného režimu (exotermická reakcia) x ΔH
 Porovnanie reaktorov podľa teplotného režimu T 2 1 1 – RIV A – adiabatický režim 2 – RIS A – adiabatický režim
Porovnanie reaktorov podľa teplotného režimu T 2 1 1 – RIV A – adiabatický režim 2 – RIS A – adiabatický režim

Volgograd, RPK "Polytechnic", 2012. - 182 s. Klasifikácia reaktorov podľa konštrukcie
Všeobecné vlastnosti a účel
Klasifikácia reaktorov podľa spôsobu pohybu reakčnej hmoty a typu teplovýmennej plochy
Klasifikácia reaktorov podľa konštrukčných foriem
Klasifikácia reaktorov podľa fázového stavu činidiel a princípu činnosti
Všeobecné charakteristiky a princípy činnosti podľa spôsobu prevádzky
Vsádzkové reaktory (homogénne nestacionárne reaktory)
Polodávkové reaktory
Kontinuálne reaktory (homogénne stacionárne reaktory)
Kaskáda reaktorov
Metodika komplexného výpočtu chemických reaktorov
Algoritmus výpočtu reaktora
Všeobecné ustanovenia
Stanovenie rýchlosti chemickej reakcie, konštanty, stupňa premeny a rádu
Rýchlosť chemickej reakcie
Jednoduché reakcie
Reakcie nultého rádu
Reakcie prvého poriadku
Výťažok produktu
Klasifikácia reakcií
Vplyv teploty na rýchlosť chemickej reakcie
Paralelné a sekvenčné reakcie
Základy matematického modelovania chemických reaktorov
Lineárne distribučné funkcie doby zdržania
Experimentálne stanovenie E(τ) a F(τ) a analýza chemického reaktora pomocou týchto funkcií
Prenos tepla v chemických reaktoroch
Tepelný efekt v reaktoroch
Klasifikácia chemických reaktorov podľa tepelného režimu
Algoritmus na výpočet tepelného režimu chemických reaktorov
Tepelný výpočet chemických reaktorov
Všeobecná charakteristická rovnica tepelnej bilancie
Vplyv tepelných podmienok na priebeh chemických procesov v ideálnych zmiešavacích a vytesňovacích reaktoroch. Tepelný výpočet kontinuálneho izotermického reaktora s plným miešaním
Analýza tepelného režimu kontinuálneho izotermického reaktora
Reaktor s piestovým tokom s výmenou tepla medzi reaktantmi a produktom
Zátkový prietokový reaktor s teplovýmennou plochou
Tepelný výpočet adiabatického reaktora s miešadlom
Analýza tepelného režimu adiabatického reaktora
Analýza tepelného režimu adiabatického reaktora pre endotermické reakcie
Tepelný výpočet izotermického vsádzkového reaktora
Tepelný výpočet izotermického vsádzkového reaktora pre kvázistacionárny režim
Príklad technologického a tepelného výpočtu chemického reaktora
Mechanizmus heterogénnych katalytických reakcií
Výpočet reaktora s pevným lôžkom katalyzátora
Výpočet reaktora s fluidným lôžkom
Prenos tepla v reaktore s fluidným lôžkom
Účel, konštrukcia a hlavné technické vlastnosti zariadení s miešacími zariadeniami
Klasifikácia procesov miešania a ich hlavné kritériá
Fyzikálna podstata procesu miešania s mechanickými miešadlami v nádobách
Prúdenie tekutiny v zariadení
Pozastavenie
Podmienky pozastavenia
Vplyv miešania na chemicko-technologické procesy
Vplyv miešania na prenos hmoty
Prenos hmoty medzi pevnou a kvapalnou fázou
Vplyv miešania na prenos tepla
Miešacie zariadenia a ich klasifikácia
Účel zariadení a oblasti ich prevádzky
Podmienený tlak a teplota média
Základné parametre zariadení
Výber a požiadavky na materiály na výrobu chemických reaktorov
Základné vlastnosti materiálov používaných pri výrobe reaktorov a ich konštrukčných prvkov
Konštrukčné vlastnosti zariadení na mechanické miešanie kvapalných médií
Návrh hlavných funkčných prvkov reaktorov s miešadlami
Vysokorýchlostné mixéry
Hydrodynamika vysokorýchlostných miešacích zariadení. Výpočet základných hydrodynamických parametrov
Nízkorýchlostné mixéry
Hydrodynamika miešania v zariadeniach s nízkootáčkovými miešadlami
Pohon miešačky
Utesnené elektrické pohony
Tesnenia hriadeľa mixéra
Hydraulické ventily
Tesnenia na pery
Tesnenia žliaz
Mechanické tesnenia
Vnútorné časti reaktora
Reflexné priečky
Tlakové potrubie
Cievky
Výpočet vnútorných zariadení
Súbor bude odoslaný na vašu e-mailovú adresu. Môže trvať 1-5 minút, kým ho dostanete.
Súbor bude odoslaný na váš účet Kindle. Môže trvať 1-5 minút, kým ho dostanete.
Upozorňujeme, že musíte pridať náš e-mail [e-mail chránený]
na schválené e-mailové adresy. Čítaj viac.
Môžete napísať recenziu na knihu a podeliť sa o svoje skúsenosti. Ostatných čitateľov bude vždy zaujímať váš názor na knihy, ktoré ste čítali. Či už sa vám kniha páčila alebo nie, ak dáte svoje úprimné a podrobné myšlienky, ľudia nájdu nové knihy, ktoré sú pre nich vhodné.
MINISTERSTVO ŠKOLSTVA A VEDY RF Volgogradská štátna technická univerzita O.Kh. Dakhin CHEMICKÉ REAKTORY RPK "Polytechnic" Volgograd 2012 8 1 KLASIFIKÁCIA REAKTOROV PODĽA NÁVRHU 1.1 Všeobecná charakteristika a účel Rovnakú reakciu je možné vykonávať v reaktoroch rôznych typov. Pri zdôvodňovaní výberu reakčného zariadenia určitého typu na uskutočnenie konkrétneho chemického procesu je potrebné vziať do úvahy možnosť jeho konštrukčného riešenia zariadenia. Komplexné pochopenie hlavných typov reaktorov používaných v rôznych priemyselných odvetviach. V súlade s tým sa na veľkom množstve návrhov reaktorov zvažujú metódy a spôsoby praktickej aplikácie chemickej kinetiky, hydrodynamiky, prenosu tepla a hmoty, potrebné pre inžiniersky návrh, výber optimálneho prevádzkového režimu a návrh reaktora. Keďže hlavným aparátom takmer každej chemickej výroby je reaktor, od jeho prevádzky závisia najmä náklady a kvalita výsledných produktov, výkon bloku, produktivita práce, kapitálové náklady atď.. Vzhľadom na veľké rozdiely v konštrukciách reaktorov je ťažké nájsť vedecky podložené kritériá na ich klasifikáciu. Zo všetkých konštrukčných charakteristík možno ešte dve považovať za rozhodujúce: - spôsob pohybu reakčnej hmoty v reaktore; - typ teplovýmennej plochy; - podľa konštrukčných foriem trupu. Prvá charakteristika umožňuje klasifikovať reakčné zariadenia podľa známych ideálnych typov reaktorov, čím sa vytvára súvislosť medzi kinetickými zákonmi procesov prebiehajúcich v reaktoroch a ich konštrukciou. Pre každý z ideálnych typov reaktorov bude návrh závisieť aj od toho, či je potrebná teplovýmenná plocha (vonkajšia, vnútorná) alebo nie (tabuľka 1). 1.2 Klasifikácia reaktorov podľa spôsobu pohybu reakčnej hmoty a typu teplovýmennej plochy Tabuľka 1.1 Režim Metóda Realizácia pohybu teplovýmennej plochy Bez Vonkajšie S reakčným pohybom povrchová plocha vnútorná hmota a povrch Plne mechanická miešaná pec s autoklávom s autoklávom miešanie s policami opláštená cievka Rotujúci bubon - - Difúzia alebo reakcia - - Konvekčná I komora; - - Reaktor s reaktorom s reaktorom s pohybmi s pohybom s pohybom pohybom pohybom minimálnej vrstvy vrstvenie reaktora pec s policami Zmiešaná konvekcia (jeden z reaktantov Vysoká pec Pneumatický 10. prebublávací reaktor s krížovým reaktorom s prebublávaním bublinková difúzia, prebublávanie zvyšok) Plná Dopredný prietokový reaktor Katalytický vytesňovací adiabatický reaktor (činidlá pohybujúce sa zo stacionárneho minima Protiprúd - Kolóna s - - - - Rotačná rotačná - difúzia priečneho plnenia pece) Reakčná kolóna s poschodiami 1. 3. Klasifikácia reaktorov podľa konštrukčných foriem. Tabuľka 1.2. Typ reaktora Con Mode Prevádzková povrchová stránka pohybujúca sa tepelná výmena ukciová fáza Bez Sivnových reakcií s vnútorným iónom super zúženým pre masový nosný mat y p povrch 11 C Príklady Rúrkové PV G - + - reaktory Krakovanie benzínov, polymerizácia etylénu L - + - Alkniácia nižších parafínov L-L - + - Hydrolýza chlórbenzénov Kolóna PV G-L + - + PV G-L + - - reaktory Neutralizácia amoniaku PV pre plyn G-L + + +, Oxidácia nxylénu NS pre kvapalný PV G-Zh + - - Výroba síranu amónneho 12 Pokračovanie tabuľka 1.2 Stĺpec PV G-G/T + - - reaktory Dehydratácia etylén-benzénu - + - Oxidácia etylénu G-T + - - Kalcinácia vápenca PV PV pre L- T + - - Výmena iónov G-T + - - G-G/T + - - Pyrolýza butánu G-T + - - Praženie G-T + + + Diazotizácia G-G + + + Chlorácia plynu, PS G-G/T pre tuhú fázu PS derivátov etylénu F + + + Sulfonácia benzénu L-T + + + Získavanie superfosfátov 13 Pokračovanie tabuľky 1.2 Ostatné široko G-T + + - Oxidácia použitých rúd G-T + - + Praženie reaktora L-T Rozklad karbidu vápnika vodou v acetyléne G-G + - + Čiastočná oxidácia uhľovodíkov na olefíny a diolefíny Poznámka: PV - úplné vytesnenie; PS - úplné premiešanie; G-plynová fáza; Kvapalina-kvapalina Klasifikácia reaktorov podľa konštrukčných foriem nádoby nie je založená na vedeckých klasifikačných kritériách, ale je blízka továrenským metódam zoskupovania reakčných zariadení (kotly, pece, rúry). Na základe ich konštrukčných foriem sú hlavné typy reaktorov rozdelené do nasledujúcich skupín: - rúrkové (reaktory typu výmenníka tepla); -kolóna (vrátane zariadení so stacionárnou alebo pohyblivou vrstvou tuhej fázy); -reaktory typu reakčnej komory (s mechanickým miešaním alebo bez neho); - iné bežne používané typy reaktorov (napr. pece). Nižšie uvádzame stručné informácie o reaktoroch rôznych konštrukčných foriem... 14 Hlavnú náplň chemickej technológie tvoria početné a rôznorodé procesy chemickej premeny látok. Vykonávajú sa v špeciálnych zariadeniach - chemických reaktoroch. Reaktor je hlavným zariadením technologického zariadenia a z hľadiska svojho významu zaujíma popredné miesto vo výrobe akýchkoľvek produktov chemického, petrochemického a potravinárskeho priemyslu. Preto je mimoriadne dôležitá znalosť a ovládanie metód technologických a konštrukčných výpočtov, výber optimálnej veľkosti reaktora, podmienok pre jeho kompetentnú a bezpečnú prevádzku, ako aj technologická oprava a inštalácia. Reaktory v technologických linkách petrochemickej a potravinárskej výroby zvyčajne zaujímajú centrálne miesto, keďže len v nich sa v dôsledku chemických reakcií vytvára potrebný cieľový produkt so špecifikovanými vlastnosťami na ďalšie použitie ako hotový produkt alebo spracovanie na určité produkty. Ostatné zariadenia zodpovedajúcej výroby sú určené na prípravu východiskových komponentov pre uskutočňovanie chemických reakcií v reaktore a spracovanie alebo spracovanie hotových reakčných produktov. Každý priemyselný chemický proces je navrhnutý tak, aby ekonomicky produkoval požadovaný produkt zo suroviny, ktorá prechádza niekoľkými po sebe nasledujúcimi fázami spracovania. Obrázok 1.l ukazuje diagram typického chemického procesu. Prvotné hydromechanické tepelné (ohrev, materiály (drvenie, s technologickou pomocou, odstreďovanie, chladenie a pod.) a rôzne iné procesy) sa podrobujú špeciálnemu spracovaniu do stavu, v ktorom sú schopné za určitých podmienok vstúpiť do chemická reakcia. 15 Potom sa do reaktora privedú východiskové činidlá, aby sa uskutočnila chemická reakcia. Pomocou určitých fyzikálnych procesov v reaktore sa vytvárajú optimálne podmienky pre chemickú reakciu. Na základe kinetických závislostí je zabezpečený optimálny reakčný čas - teplotný režim a reakčná teplota - hydrodynamický režim a prevádzkový tlak reaktora, stav činidiel a ich koncentrácie - fáza, ako aj zodpovedajúca konštrukcia. I – zariadenie na prípravu počiatočných činidiel pre chemickú reakciu v reaktore; II – zariadenie na spracovanie a spracovanie hotového produktu získaného v reaktore. 1 chemický reaktor; 2 – sušička; 3 – prístroj na prenos hmoty; 4 – extrudér; 5- kapacita; 6 – odstredivka; 7 – filter; 8 – výmenník tepla (chladnička). Obrázok 1.1 – Chemický reaktor v technologickej schéme petrochemickej výroby 101; Všetky chemické reaktory pozostávajú zo štandardných konštrukčných prvkov a aparátov, sú to miešačky, dávkovače, filtre, odstredivky, výmenníky tepla (chladničky), sušičky atď., ako aj kontaktné zariadenia - platne, dýzy, katalyzátory a miešacie zariadenia na plyn a kvapalné fázy. Konštrukčne môže byť reaktor jednoduché zariadenie, napríklad jednoduchá miešacia nádrž, avšak vo väčšine technologických schém v rôznych priemyselných odvetviach je reaktor hlavným zariadením, pretože chemická fáza je najdôležitejšou súčasťou procesu. Navrhovanie reaktora je zložitá inžinierska úloha, pretože pre daný chemický proces je možné použiť rôzne typy zariadení. Preto na návrh, výpočet a výber optimálneho návrhu je potrebné použiť vzory a údaje z rôznych oblastí poznania: termodynamika, chemická kinetika, hydrodynamika, prenos tepla, prenos hmoty a ekonómia. 1.4 Klasifikácia reaktorov podľa fázového stavu činidiel a princípu činnosti Chemické procesy sa uskutočňujú v zariadeniach rôznych konštrukčných typov, pracujúcich podľa jedného z nasledujúcich prevádzkových princípov: - vsádzkový reaktor; - polovsádzkový a polokontinuálny reaktor; - kontinuálny reaktor. V týchto reaktoroch môžu byť činidlá v rôznych fázových stavoch: plyn, kvapalina, plyn-kvapalina, kvapalina-kvapalina, plyn-tuhá látka, kvapalina-tuhá látka, plyn-kvapalina-tuhá látka. Reakcie v týchto fázach sa uskutočňujú v zariadení, v ktorom sa uskutočňuje miešanie. pohyb reagentov V súlade s tým sú zariadenia vo vytesňovacom režime buď konštrukčne navrhnuté vo forme vytesňovacieho reaktora alebo miešaného reaktora. Zariadenia s výtlakom: zvyčajne kontinuálne a s miešaním, kontinuálne aj periodické. Periodické procesy sa uskutočňujú v reaktoroch s miešaním v homogénnych (L) a heterogénnych (L+G; Ll+L2; G+Tv.t; G+L+Tt) systémoch. Periodické procesy zahŕňajú: -polymerizačné procesy (L); -semiperiodická chlorácia (G+L) -sulfonácia (Ll+L2); -recyklácia (G + TV); -Ek minerály (L+Tv.t.); -hydrogenácia (G + F + Tv.t.). Kontinuálne procesy sa uskutočňujú v reaktoroch s piestovým tokom aj v zmiešavacích reaktoroch. Nepretržité procesy zahŕňajú: - tepelné krakovanie (G); -absorpcia (G + F); -extrakcia(Ll+L2); -nitrácia (Ll+L2); -procesy prebiehajúce v stacionárnej alebo pohyblivej suspendovanej vrstve katalyzátora (G+TV.t.); -iónová výmena (F+Tv.t.). Schémy implementácie vyššie uvedených procesov sú uvedené v tabuľke 1.3. 103 Tabuľka 1.3 104 2 VŠEOBECNÉ CHARAKTERISTIKY A PRINCÍPY ČINNOSTI PODĽA PREVÁDZKOVÉHO REŽIMU 2.1 Vsádzkové reaktory (homogénne nestacionárne reaktory) Do reaktora (obrázok 2.1), ktorý pozostáva z nádoby s miešadlom, sa súčasne vkladajú všetky reagencie. Intenzívne miešanie zaisťuje kedykoľvek rovnakú koncentráciu v celom objeme. Proces sa uskutočňuje dovtedy, kým sa nedosiahne rovnováha alebo požadovaný stupeň konverzie. Čas zotrvania komponentov v reakčnej zóne je určený intervalom medzi okamihmi zaťaženia a vyloženia zariadenia. Takéto zariadenia, používané na reakcie v kvapalnom médiu, pracujú v ideálnom (úplnom) režime miešania. Vsádzkové reaktory sa vo väčšine prípadov používajú na homogenizáciu procesov a relatívne rozpúšťanie, široké riedenie, rozsah chemických premien. Rozhodujúcimi faktormi ovplyvnenými miešaním sú prenos hmoty a prenos tepla. V dôsledku miešania sa reagujúce zložky dostávajú do úplnejšieho a tesnejšieho kontaktu a reakcia sa zrýchľuje, dochádza k výmene tepla cez plášť alebo cievku. Zloženie reakčnej zmesi sa časom mení, takže rýchlosť reakcie nie je počas procesu konštantná. Zmeny v koncentrácii spotrebnej zložky sú znázornené v diagrame (obrázok 2.2). Z diagramu vyplýva, že koncentrácia spotrebnej zložky vo východiskových kovoch časom klesá a reakčné produkty sa zvyšujú. periodický Pracovný cyklus s plnou akciou pozostáva z cyklu doby prevádzky nakladania, doby chemickej reakcie reaktora až do danej transformácie produktov reakcie a doby nakladania. 105 Obrázok 2.1 - Schéma vsádzkového reaktora Obrázok 2.2 - Schéma zmien koncentrácií počiatočnej zložky a reakčných produktov 2.2 Polovsádzkové reaktory Konštrukcia polokontinuálneho (polovsádzkového) reaktora je podobná ako vsádzkové reaktory. Rozdiel je v princípe fungovania. Ak sa všetky počiatočné činidlá vložia do vsádzkového reaktora 106 súčasne, potom sa do semikontinuálneho reaktora vloží niektoré z reagentov na začiatku procesu a druhé sa kontinuálne privedie do zariadenia počas procesu. Takéto reaktory je vhodné použiť v prípade nebezpečenstva nadmerného nárastu teploty alebo vedľajších reakcií vyskytujúcich sa pri vysokých koncentráciách niektorej zo zložiek. Napríklad pri reakcii A + B - C sa do zariadenia najskôr vloží zložka A, zložka B sa kontinuálne dodáva a počet jej mólov nB sa zvolí tak, aby sa získalo maximum cieľového produktu (obrázok 2.4). . Diagram zmien koncentrácie v semikontinuálnom reaktore je uvedený na obrázku 2.3. Obrázok 2.3 - Diagram zmien koncentrácie vo vsádzkovom reaktore 2.3 Kontinuálne reaktory (homogénne stacionárne reaktory) Princípy činnosti kontinuálnych reaktorov sú nasledovné; nakladanie východiskových látok a vykladanie reakčných produktov do aparatúry s miešadlom sa uskutočňuje kontinuálne. V dôsledku toho 107 nebol stanovený presný čas zotrvania častíc v reakčnej zóne: zrejme len malý počet častíc bude schopný veľmi rýchlo prejsť dráhu od vstupu k výstupu zariadenia. Väčšina častíc v dôsledku miešania prechádza veľmi ťažkou cestou, aby opustila reaktor. Preto pri výpočte takýchto reaktorov je skutočný čas zotrvania zložiek v reakčnej zóne nahradený takzvaným ekvivalentným časom alebo priemerným časom zotrvania častice v reaktore (obrázok 2.4). Pretože východiskové materiály sú kontinuálne dodávané a reakčné produkty sú kontinuálne odstraňované, ich koncentrácie budú konštantné v akomkoľvek bode reakčného objemu a v akomkoľvek čase; reakčná rýchlosť bude tiež konštantná v priebehu času a objemu zariadenia. Koncentrácia zložky pri naplnení je rovná c0, teoreticky okamžite klesá na konečnú koncentráciu c a zostáva konštantná, kým sa hotový produkt nevyberie z reaktora. Diagram (obrázok 2.5) znázorňuje charakter zmeny koncentrácie a reakčnej rýchlosti v kontinuálnom reaktore. 108 Obrázok 2.4 - Schéma kontinuálneho reaktora Obrázok 2.5 - Schéma zmien koncentrácie v kontinuálnom reaktore 2.4 Kaskáda reaktorov Schéma inštalácie je znázornená na obrázku (Obrázok 2.6). Prúd reakčných činidiel nepretržite prúdi z každého reaktora do ďalšieho reaktora, aby ďalej prebiehala reakcia. Koncentrácie východiskových látok sa postupne menia. Je možná aj iná stupňovitá verzia prevádzky kaskády reaktorov, v ktorej sa obsah každého reaktora periodicky prenáša do nasledujúceho. Vykladanie reakčných produktov z posledného zariadenia je tiež periodické. Obrázok 2.6 - Schéma kaskády kontinuálnych reaktorov a schéma zmien koncentrácií podľa stupňov 2.5 Rúrkové reaktory Sú to zariadenia, ktorými kontinuálne prechádza prúd činidiel, ktoré medzi sebou vstupujú do chemickej interakcie (obrázok 2.7). Existujú reaktory pre homogénne a heterogénne procesy. Podmienky prúdenia v rúrkových reaktoroch sú veľmi zložité. V prvej aproximácii miešania ako miešania je možné povoliť pohyb tokov dovnútra a von bez smeru pohybu (pozdĺžny radiálny smer (priečne miešanie). V skutočnosti je obraz oveľa komplikovanejší: prítomnosť pozdĺžnych a priečne miešanie má ďalšie vplyvy na tok. V neprítomnosti pozdĺžneho miešania bude trvanie zotrvania činidiel v reakčnej zóne určené dĺžkou zariadenia a rýchlosťou častíc, ktoré nie sú rovnaké naprieč prierez aparatúry.Ak uvažujeme rúrkový reaktor ako zariadenie ideálneho výtlaku (tzv. piestový režim), potom sa doba zotrvania molekuly v reakčnej zóne 110 rovná pomeru dĺžky zóny na pozdĺžnu rýchlosť. Turbulizácia tokov a pozdĺžne miešanie komplikujú výpočet doby zdržania, preto sa zavádza pojem priemerná doba zdržania. Na konci doby nábehu sa v každej sekcii reaktora v dôsledku chemickej interakcie ustanovia konštantné koncentrácie spotrebnej zložky, ktoré klesajú vo východiskových materiáloch od vstupu k výstupu. Rúrkové reaktory sú široko používané v chemickom a petrochemickom priemysle. Pre rúrkové reaktory existujú dve hlavné prevádzkové schémy: prietokový (obrázok 2.7) a recirkulačný (obrázok 2.6). Obrázok 2.7 - Schéma prietokového rúrkového reaktora a schéma zmien koncentrácií východiskového a hotového produktu 111 Obrázok 2.8 - Schéma reaktorovej inštalácie s recirkuláciou. 1 reaktor; 2-oddeľovač; 3-výmenník tepla; 4 - obehové čerpadlo Táto schéma zodpovedá krakovaniu plynového oleja, reformovaniu ľahkých produktov podľa jednoramennej schémy, ako aj procesom syntézy z jednotlivých komponentov. Zariadenia fungujúce podľa špecifikovanej schémy sú široko používané v priemysle, najmä v ropných rafinériách. Je to spôsobené nasledujúcimi dôvodmi: vo väčšine prípadov nie je možné bez recyklácie dosiahnuť požadovaný stupeň konverzie reagujúcich látok; mnohé procesy sú sprevádzané paralelnými alebo vedľajšími reakciami v dôsledku teplotných porúch. Aby sa predišlo zvýšeniu výťažnosti vedľajších produktov, úplná konverzia surovín je zabezpečená využitím recyklácie. Pri výrobe motorových palív sa reakcia často uskutočňuje s veľkým prebytkom niektorej zo zložiek suroviny. Napríklad pri prebytku izobutánu sa izooktán syntetizuje z izobutánu a izobuténu; s nadbytkom benzénu - syntéza izopropylbenzénu z benzénu a propylénu. V týchto prípadoch sa nadbytočné množstvo zložky zavádza spolu s recirkuláciou. Podstata spôsobu spočíva v tom, že nezreagované produkty spolu so zreagovanými vstupujú za reaktorom do separačného systému 112, kde sa od neho oddelia a zmiešané s čerstvými surovinami sa privádzajú späť do reaktora. 113 4 METÓDA KOMPLEXNÉHO VÝPOČTU CHEMICKÝCH REAKTOROV Chemické reakcie prebiehajú v reaktoroch rôznych typov. Návrh a výber veľkosti aparatúry pre konkrétny chemický proces (chemickú reakciu) závisí od mnohých faktorov, fázového stavu počiatočných činidiel a ich fyzikálno-chemických vlastností, procesov prenosu tepla a hmoty a hydrodynamiky. Navyše všetky tieto procesy prebiehajú súčasne, čo značne komplikuje návrh a výpočet chemických reaktorov. Možnosť získania najoptimálnejších technologických a konštrukčných parametrov sa objavuje pri použití komplexného výpočtu reaktora. 4.1 Algoritmus výpočtu reaktora Na vytvorenie reaktora optimálnej konštrukcie sú potrebné počiatočné údaje, ako sa hovorí. V prvom rade by ste mali vedieť o kinetike cieľového produktu a o vedľajších procesoch, ktoré vedú k iracionálnej spotrebe surovín a tvorbe nepotrebných a niekedy aj škodlivých látok (kinetika je veda o rýchlostiach chemických reakcií). Ďalej sú potrebné údaje o uvoľnenom alebo absorbovanom teple počas reakcie a o maximálnom možnom stupni premeny východiskových látok na produkty. Na tieto otázky odpovedá chemická termodynamika. Pretože sa molekuly východiskových reaktantov musia navzájom stretnúť, aby prebehla reakcia, reakčný systém musí byť dobre premiešaný. Účinnosť miešania závisí od viskozít zložiek, vzájomnej rozpustnosti východiskových látok a produktov, prietokov, geometrie reaktora a rôznych typov zariadení na vstup reagencií. Týmito otázkami sa zaoberá veda zvaná hydrodynamika. Výskyt chemickej reakcie ovplyvňuje aj miešanie. Toto je študované fyzikálno-chemickou hydrodynamikou. Nakoniec, teplota v reaktore by sa mala udržiavať v súlade s kinetickými požiadavkami, aby sa optimalizovali reakčné rýchlosti a výťažok cieľa a vedľajších produktov. Veda, ktorá sa zaoberá popisom chemických reakcií s prihliadnutím na procesy prenosu hmoty a tepla, sa nazýva makrokinetika (makroskopická kinetika). 1. V závislosti od typu chemickej reakcie (jednoduchá, komplexná, exo- a endotermická), množstva počiatočných činidiel a produktov materiálovej reakcie sa určujú toky, ktoré tvoria všeobecnú charakteristickú rovnicu materiálovej bilancie. 2. Zisťujú sa základné fyzikálne vlastnosti látok a ich zmesí. 3. Vypočítajú sa kinetické charakteristiky štádia chemických premien. Na základe čoho sa určí jedna z hlavných vypočítaných hodnôt - čas chemickej reakcie - r. 4. Výsledkom analýzy vlastností tohto typu chemickej reakcie je hardvérová konštrukcia vo forme jedného zariadenia s miešadlom, kaskádou reaktorov atď. (Vybrané z katalógov, normálií a príručiek). 5. Po stanovení špecifických technologických vlastností zvoleného konštrukčného typu reaktora sa všeobecná charakteristická rovnica materiálovej bilancie pretransformuje na charakteristickú rovnicu periodickej, kontinuálnej, zodpovedajúcej typu reaktora: ideálne zmiešavacie alebo ideálne výtlakové, polo- dávková prevádzka. Z charakteristickej rovnice tohto typu reaktora, ktorá vyjadruje vzťah všetkých hlavných parametrov charakterizujúcich chemický reaktor - G, p, Vr (G - produktivita, p - reakčný čas 115 a V r - objem reaktora), určuje sa hlavný konštrukčný parameter reaktora: jeho objem Vr a podľa toho aj povrch F. 6. V reaktoroch s miešacím zariadením sa pre špecifické chemické procesy v prvom rade volí typ miešadla v závislosti od vykonávaného procesu. v prístroji (katalógy, normály a referenčné knihy). Miešacie zariadenie v reaktore je teda hlavným funkčným konštrukčným a technologickým prvkom, ktorého správna voľba a jeho výpočet závisí od optimálnych technologických a tepelných prevádzkových podmienok reaktora. 7. V závislosti od viskozity, koncentrácie, teploty a ďalších fyzikálnych a mechanických vlastností média sa určujú otáčky zvoleného typu miešačky. Od správneho určenia rýchlosti miešadla závisí intenzita miešania chemických činidiel, stupeň segregácie vstupných prúdov, ktorý určuje prírastok látok v chemickej reakcii, ako aj procesy prenosu tepla a hmoty. V tejto fáze algoritmu sa vypočíta počet otáčok mixéra n, nominálny výkon vynaložený na miešanie je N n, strata energie v tesneniach je N y, výkon pre interné zariadenia je N B a celkový výkon pohonu. miešačky je N. 8. Tepelný výpočet pozostáva zo zostavenia všeobecných charakteristických rovníc reaktora. Po stanovení všetkých špecifických vlastností daného reaktora sa rovnica tepelnej bilancie pretransformuje na charakteristickú rovnicu príslušného adiabatického typu reaktora: neizotermický, izotermický, polytropický, autotermický. Z charakteristickej rovnice uvažovaného reaktora, ktorá vyjadruje vzťah všetkých hlavných termofyzikálnych parametrov charakterizujúcich tepelný prevádzkový režim aparatúry Qr, QK, Qf, 116 Q , Qф, QM (Qr je množstvo uvoľneného tepla resp. absorbovaný pri chemickej reakcii, QK je prenos tepla konvekciou, Qf - prenos tepla povrchom, Q - zmena množstva tepla v objeme reaktora, Qf - množstvo tepla uvoľneného alebo absorbovaného pri fyzikálnych procesoch (rozpúšťanie , odparovanie, adsorpcia, kryštalizácia a pod.) pri tepelnom efekte / N f [kJ/mol] Po určení hlavných tepelných parametrov sa analyzuje stabilita prevádzky reaktora podľa tepelného režimu a optimálnej prevádzky. sú stanovené teploty. 9. V konštruktívnom výpočte je vyššie stanovený objem reaktora Vr - a povrch - F stelesnený v konkrétnom geometrickom tvare (priemer - D a výška zariadenia - H), priemer hriadeľa miešadla - dB, priemer miešadla - dm, vypočítajú sa rozmery armatúr a potrubí, tesniacich zariadení a základné vzťahy medzi rozmermi prvkov miešacieho zariadenia (priemer miešadla - dM a priemer telesa DM, vzdialenosť miešadla zo spodnej časti zariadenia až po hladinu kvapaliny v reaktore atď.). 10. Pevnostný výpočet je záverečnou fázou komplexného výpočtu reaktora. Je potrebné pochopiť, že pri výbere konštrukčných materiálov pre chemické reaktory a pomocných zariadení k nim samotný materiál neovplyvňuje chemický proces v objeme reaktora, ale môže výrazne ovplyvniť procesy prenosu tepla, najmä v prípade použitia ne -kovové povlaky (guma, smalt atď.) .P.). V dôsledku katalytického účinku konštrukčného materiálu v oblasti blízko steny je tiež možná tvorba vedľajších produktov (škodlivé, nežiaduce) produkty reakcie. 117 Preto pri tých procesoch, kde je limitujúcim štádiom proces prenosu tepla, je potrebné vopred vybrať konštrukčný materiál. 118 Obrázok 4.1 - Algoritmus výpočtu chemického reaktora 119 5 VŠEOBECNÉ USTANOVENIA Pri technologickom návrhu novej chemickej reakcie je potrebné stanoviť: za akých podmienok môže táto reakcia prebiehať a aká je jej rýchlosť za zvolených podmienok. Odpoveď na prvú otázku dáva chemická termodynamika, na druhý oddiel fyzikálnej chémie chemická kinetika, ktorá skúma priebeh chemického procesu v čase. K tvorbe nových látok počas chemických reakcií dochádza v dôsledku interakcie medzi elektrónmi atómov a molekulami reagujúcich látok. Tieto interakcie sú zase určené pravdepodobnosťou zrážok medzi rôznymi atómami a molekulami. Preto je celkom zrejmé, že chemická reakcia je mikroskopický proces. V niektorých reakciách sa získa iba cieľový produkt; Iné reakcie tiež produkujú vedľajšie produkty. Existujú reakcie, ktoré poskytujú nepretržitý rad hlavných a vedľajších produktov. V reakcii A + B = C je napríklad látka C jediným produktom. Pri reakcii A + B = C + D je cieľový produkt C sprevádzaný určitým vedľajším produktom D. V zlúčeninách obsahujúcich uhlík má uhlíkový reťazec dobre definovanú štruktúru, ale počet atómov uhlíka v molekule sa môže meniť. Vo všeobecnosti je potrebné mať na pamäti, že pri reakciách anorganických látok vznikajú niektoré hlavné a vedľajšie produkty. Zároveň pri organických reakciách (najmä polymerizačných), pri ktorých sa uskutočňuje distribúcia látok podľa ich molekulových hmotností, je rozlíšenie medzi hlavnými a vedľajšími produktmi v podstate neisté. Ako už bolo uvedené, chemická reakcia je mikroskopický proces. V teórii výpočtu, regulácie a riadenia chemických procesov však možno priamo brať do úvahy intermolárne (intermolekulárne) 120 sily, ktoré si vynucujú asociáciu alebo individuálnu disipáciu, nie atómy (molekuly). Vznik alebo zničenie produktu sa musí posudzovať výlučne z makroskopického hľadiska. 5.1 Stanovenie rýchlosti chemickej reakcie, konštanty, stupňa premeny a rádu Pri výpočte reaktorov je potrebné poznať rýchlosť reakcie, jej poradie, rýchlostnú konštantu a stupeň premeny. Tieto výpočty sú založené na experimentálnych údajoch. Kinetické rovnice chemických reakcií umožňujú za prítomnosti vhodných údajov o rýchlosti reakcie určiť okamžité hodnoty rýchlostných konštánt k a dobu trvania reakcie na dosiahnutie daného stupňa konverzie. Priemernú rýchlosť reakcie vyjadrujú diferenciálne rovnice, ktoré sú zostavené na základe teórie kinetiky. Tieto rovnice berú do úvahy množstvo surovín spotrebovaných za jednotku času alebo množstvo produktu vyrobeného za jednotku času. 5.1.1 Rýchlosť chemickej reakcie Najdôležitejšou kvantitatívnou charakteristikou procesu chemickej premeny látok je rýchlosť chemickej reakcie, teda zmena počtu mólov zložky na jednotku objemu reakčného prostredia za jednotku času. : r 1 dn , V d (5.1) kde V sú objemovo reagujúce zložky, m3; n je počet mólov ktorejkoľvek spotrebnej (klesajúcej) zložky (je to označené znamienkom mínus); - čas, sek. 121 Vo všeobecnom prípade je V časovo premenná veličina. Ak V = const, potom n = cV, kde c je koncentrácia spotrebovanej zložky v čase , potom r d cV dс . d d (5.2) Na základe toho, že objem reaktora VR V získame: r 1 dn V R d [počet vytvorených mólov/(jednotkový objem reaktora) čas] V dvojfázových systémoch, na báze na fázovej kontaktnej ploche S máme: r 1 dn S R d [počet vytvorených mólov/(jednotka kontaktnej plochy) čas] Pri reakciách s tuhou fázou: r 1 dn M d [ počet vytvorených mólov/(jednotky hmotnosti pevnej látky M) čas] Vo všeobecnosti možno rýchlosť chemickej reakcie zapísať ako: dc kc A11 c A22. .. d (5.3) Tento výraz sa nazýva kinetická rovnica chemickej reakcie. V ňom je k rýchlostná konštanta reakcie, 1 a 2 sú reakčné rády v zložkách A 1 a A 2. Celkové poradie reakcie sa rovná súčtu rádov jednotlivých reaktantov: 1 2 ... . 5.1.2 Jednoduché reakcie Jednoduché reakcie môžu byť nultého, prvého, druhého a vyššieho rádu. 122 5.1.2.1 Reakcie nultého rádu Rýchlosť týchto reakcií nezávisí od koncentrácie C a konštanta Kp je konštantná v čase: dc kc 0 k const d (5. 4) 5.1.2.2 Reakcie prvého rádu V tomto prípade je rýchlosť reakcie úmerná prvému stupňu koncentrácie reaktantu. Označme CB koncentráciu vznikajúcej látky (napríklad B) v momente τ a CA koncentráciu látky A reagujúcej v rovnakom okamihu. Potom v diferenciálnom tvare rýchlosť zmeny stupňa konverzie alebo koncentrácie možno znázorniť ako (5.5): =− = (5.5) Výsledkom integrácie (5.5) získame závislosť (5.6): =− ∫ ln kde = −k τ τ ∫ (5.6) = a (5.7) je počiatočná koncentrácia reaktantu A. Je zrejmé, že CA = − C A koncentrácia A bude rovná: CA = = −C a počtu zreagovaných mólov: CB = − CA = (1 −) ( 5.8) Pre akúkoľvek zložku: CB = (1 −) (5.9) 5.1.3 Výťažok produktu Výťažok produktu (stupeň konverzie) - X (5.10) pomer množstva produktu získaného ako výsledok chemickej transformácie k množstvu vstupného materiálu prijatého na spracovanie. Ak sa dá priebeh chemického procesu kvantitatívne vyjadriť stechiometrickou rovnicou, potom výťažok konečného produktu možno zistiť v percentách ako pomer prakticky získaného množstva produktu k teoreticky možnému množstvu v súlade s tzv. stechiometrická rovnica. 5.1.4 Klasifikácia reakcií Klasifikácia reakcií. V závislosti od mechanizmu možno reakcie rozdeliť na jednoduché (priame) a zložité. Jednoduché (priame) reakcie prebiehajú jedným smerom a zahŕňajú jeden chemický krok. Komplexné reakcie sú rozdelené nasledovne: reverzibilné reakcie; paralelné reakcie; sekvenčné reakcie; spojené reakcie, keď jedna reakcia prebieha spontánne a druhá iba v prítomnosti prvej; kombinácia uvedených reakcií. 5.2 Vplyv teploty na rýchlosť chemickej reakcie Rýchlosť chemickej reakcie je veľmi citlivá na zmeny teploty, pretože tá výrazne ovplyvňuje rýchlostnú konštantu k zahrnutú v rovnici. Najpoužívanejším výrazom je závislosť rýchlostnej konštanty od teploty vo forme Arrheniovej rovnice. Keďže koncentrácie reagujúcich látok nezávisia od teploty, vyjadrenie rýchlosti chemickej reakcie bude mať tvar: =− = = (5.11) Konštanty z a E sa zisťujú experimentálne. Logaritmom vyjadrenia (5.12) dostaneme rovnicu priamky v súradnicovom systéme (1/T, Ln k). Z graficky zisteného uhla sklonu tejto priamky s vodorovnou osou 1/T sa určí tan a = E/R, z čoho sa zo známej plynovej konštanty R získa hodnota aktivačnej energie E. Ak hodnota rýchlostnej konštanty k je známa pri určitej teplote T a hodnote E, potom z rovnice (5.12) je ľahké nájsť predexponenciálny faktor: z= Parameter E v prípade minimálnej energie (5.12) jednoduchých reakcií ukazuje že reagujúce častice majú také, že ich zrážka (aktívna) vedie k vzniku nových chemických zlúčenín. Preto sa parameter E nazýva aktivačná energia. Ak sa v systéme vyskytne niekoľko reakcií, potom so zvyšujúcou sa teplotou sa rýchlosť reakcie s väčšou hodnotou E zvýši v porovnaní s ostatnými rýchlejšie. 5.3 Paralelné a sekvenčné reakcie Paralelné reakcie. Uvažujme reakcie typu A→B A→C Táto schéma sa vyskytuje napríklad pri chlorácii zmesi benzénu a toluénu. Podľa vzorca (5.7) máme: = = () = (5.13) V tomto prípade sú možné dva prípady: a) = A ≠ b) z výrazu (5.13) zistíme: () = Rozdiel a najviac sa prejavuje pri nižších teplotách Napríklad, ak je rozdiel aktivačnej energie 125 − =∆ = 2400 cal ∗ mol a teplota T = 300; 600 a 900 °K, R=1,987≈2 cal*mol, potom pri ∗ stupni dostaneme: =e ∗ = =e ∗ = =e ∗ = , Inými slovami, rýchlosti paralelných reakcií sa výrazne líšia pri nízkych teplotách . Preto sa za takýchto podmienok uskutočňujú typické paralelné reakcie, napríklad chlorácia a oxidácia uhľovodíkov v kvapalnej fáze. Zdá sa, že zvýšenie teploty neutralizuje reaktivitu reagujúcich častíc. Nech je teraz teplota ⁄ =0,001 smer − ≠ . Ak reakcie<
может
<
, то при изменении
измениться.
Например,
= ∆ = −6000 кал ∗ моль
Тогда при Т= 300,600, 750 °К и том же значении R находим:
=
22
1
= 0,001e
∗
= 0,001 e
= 0,001e
∗
= 0,001 e =
15
100
= 0,001e
∗
= 0,001 4 =
5,5
100
Отсюда следует, что первая реакция (с константой скорости
при
Т = 300 ◦К) имеет преимущественное значение: ее скорость в 22 раза
больше скорости второй реакции. При Т = 750 °K скорость первой
реакции составляет только 5,5% скорости второй реакции, а при
дальнейшем повышении температуры она станет исчезающе малой.
Последовательные реакции. Такие реакции включают стадии
126
образования промежуточных продуктов. Примером может служить
реакция хлорирования бензола до монохлорбензола и последующего его
хлорирования в дихлорбензол и высшие хлорпроизводные. Рассмотрим
две последовательные реакции первого порядка
A → B→ C
127
7 ОСНОВЫ МАТЕМАТИЧЕСКОГО МОДЕЛИРОВАНИЯ
ХИМИЧЕСКИХ РЕАКТОРОВ
7.1 Линейные функции распределения времени пребывания
Ранее мы рассмотрели идеальные реакторы вытеснения и смешения.
При этом считалось, все молекулы имеют одно и то же время пребывания.
В
реальных
реакторах
движущие
частицы
имеют
разное
время
пребывания. Поэтому при вычислении степени превращения - Х,
необходимо помнить, что идеальный реактор не соответствует реальному.
Возникает вопрос о том, какая должна быть поправка к вычисленной Х.
Чтобы судить о возможности Промышленного применения различных
реакторов экспериментально определяют среднее и действительное время
пребывания и дают оценку этим данным с помощью теории вероятности.
Распределение времени пребывания в реакторе может быть количественно
охарактеризовано на основе функции плотности распределения.
E T
dF d QN / QN o
e
d
d
,
(7.1)
Функция Е(Т) для реактора смещения представляет функцию
плотности распределения времени пребывания и характеризует долю
материала, которая находится в реакторе в интервале времени между Т и
Т +dT
F T E d
0
QN
QN o
Функция Р(Т) представляет функцию,
распределения
(7.2)
Р(Т)
и
характеризует долю материала, которая находиться в реакторе время
меньше, чем Т. Или иначе Е(Т) представляет объемную долю выходящего
потока с «возрастом» меньше Т. Таким образом зная одну из функций
распределения, можно получить другую. Между среднем временем
пребывания T и E(T) существует следующая зависимость:
128
m QV E d
v
v
0
,
(7.3)
То есть, зная E(τ) можно определить Vr или τ.
Функция E(τ) и Р(x) имеют еще следующие свойства; соответственно
(рисунки 7.1 и 7.2).
Рисунок 7.1 - Функция плотности распределения времени пребывания
E(τ)
Рисунок 7.2 - Функция плотности распределения времени пребывания
Р(x)
В выражениях E(τ) и F(τ) целесообразно использовать относительное
(безразмерное) время пребывания.
129
=
действительное время пребывания
среднее время пребывания
=
∙
(7.4)
Для каскада реакторов смешения E(τ):
E
mm
m1 e
m
1
!
(7.5)
Для реакторов смешения E(τ):
F 1 е
(7.6)
Для каскада реакторов смешения F(τ):
m
F 1 е
m 1 m
1
2!
2
m
1
...
m 1 !
m 1
(7.7)
7.2 Экспериментальное определение E(τ) и F(τ) и анализ
химического реактора с помощью этих функций
Для определения τ через E(τ) и F(τ) реактор исследуют путем ввода
трассирующего вещества (краска, изотопы, кислоты, основания и т.д.) и
измерения сигнала на выходе в функции времени. Трассер не должен
испытывать химического превращения (рисунки 7.3, 7.4).
Для определения E(τ) небольшое количество трассера вводится в
виде импульса, т.е ступенчатого изменения концентрации на входе и
измеряют изменение концентрации Сm/Co-f(τ) на выходе из реактора, это
соотношение изменяется от 0 до 1.
Рисунок 7.3 - Экспериментальное определение функций плотности
130
распределения E(τ) и распределения F(τ) с помощью трассера для
одиночного реактора полного смешения и каскада реакторов
трассер
идеальный реактор
реальный реактор
Рисунок 7.4 - Экспериментальное определение функций плотности
распределения E(τ) и распределения F(τ) с помощью трассера для
идеального и реального реакторов
Рисунок 7.5 - Анализ работы одиночного реактора полного смешения
и каскада реакторов с помощью функций плотности распределения E(τ) и
распределения F(τ)
131
Рисунок 7.6 - Анализ работы «идеального» реактора и реального
с помощью экспериментально определенных функций E(τ) и F(τ)
Рисунок 7.7 - Сравнение функций распределения конечных реакций
при различных значениях m
132
Объемная доля вещества выходящего из реактора за время
определяется как
F()
Qv
C
Qv0 Co
,
(7.8)
а это пропорционально относительной концентрации.
Функции
распределения
для
важнейших
типов
химических
реакторов приведены выше (рисунок 7.5) На практике встречаются
аппараты, условия работы в которых очень сложные (например,
вращающая печь, крекинговые установки и т.д.) которые трудно
сопоставить с теми или иными типами идеального реактора. В этих
случаях
применимы
методы
Гофмана-Шенемана,
основанные
на
графических методах.
По опытным данным на графике строится зависимость С/СО - τ
отсюда по уравнению С/Со = 1 – Х - можно сразу получить величину
выхода продукта. На эту же диаграмму наносится измеренная F(τ), а затем
перестраивается в зависимость С/СО
F(τ) (рисунок 7.8). Полученные
результаты дают точность до 10%.
Рисунок 7.8 - Графический метод определения функций
распределения F(τ) Гофмана-Шенемана
133
8 ТЕПЛООБМЕН В ХИМИЧЕСКИХ РЕАКТОРАХ
Температура является важным динамическим параметром для
химических реакторов. Она возрастает, если тепло выделяемое при
(экзотермической) реакции, не может быть достаточно быстро отведено
при помощи теплоносителя (конвективный теплообмен) или путем
проводимости (кондуктивный теплообмен) и излучения.
Для некоторых типов химических реакторов, особенно таких, в
которых реакция идет в газовой фазе (реакторы типа печей) выделяется
значительное количество тепла, характерно тепловое саморегулирование.
С другой стороны, экзотермические реакции типа полимеризации могут
сопровождаться выделением таких больших количеств тепла, что
происходит разложение (деструкция) компонентов смеси, состоящей из
исходного сырья,.. полупродуктов и конечных продуктов. Так как скорость
реакции является возрастающей функцией температуры (например закон
Аррениуса), то в конечном счете может измениться направление реакции.
Вследствие конструктивных недостатков теплообменных устройств
реактора, теплообмен в нем может быть затруднен, что, естественно,
ухудшает возможность регулирования температуры. Побочные реакции
возникают также в результате наличия в реакторе «застойных зон»;
автокаталитического воздействия материала элементов реактора в сторону
образования побочных продуктов реакции; в результате неправильного
перемешивания в реакторе; при этом в нем образуются «горячие пятна» и
рост скорости реакции в данной области приближает её к условиям взрыва.
8.1 Тепловой эффект в реакторах
Часто химические реакции сопровождаются выделением или
поглощением тепла, то есть экзотермическим или эндотермическим
тепловым
эффектом.
Если
реакция
протекает
экзотермически,
то
необходимо определенное количество тепла отвести от реактора, а при
эндотермическом эффекте подвести к нему. Когда реакция протекает
134
адиабатически, температура в реакторе изменяется и. следовательно,
меняется скорость реакции.
Зависимость скорости химической реакции - r от температуры
реакционной массы в реакторе определяется из уравнения Аррениуса
K=K e
(8.1)
Из (8.1) следует, что скорость химической реакции – r определяется
зависимостью (8.2)
r = K e C C . . C , (8.2)
КО - экспериментальная константа, R - газовая постоянная, Е энергия активации, она показывает, какой минимальной энергией должны
обладать реагирующие частицы, чтобы их столкновение привело к
образованию новых химических соединений.
Если E=(10÷ 60) ∗ 10
ккал
кмоль, то повышение Т на 10°С дает
увеличение К в (1,2-2,5) раз.
Зависимости r = f(Т) для различных химических реакций приведены
на Рис.(8.1 и 8.2)
Рис. 44. Зависимость скорости
Рис.45. Зависимость скорости
химической реакции r = f(Т) для:
реакции r = f(Т)для:
а- простых необратимых реакций А В; б - гетерогенных процессов,
если определяющий этап реакции - диффузионный, слабо зависящий от
температуры; в - при горении и химических реакциях, протекающих в.
135
пламени; г - обратимых реакций А и В; д - реакций окисления окиси азота
и углеводородов.
Чтобы знать условия, в которых осуществляется определенный
тепловой
режим
реактора
изотермический,
адиабатический
или
программированный - необходимо составить тепловой баланс реактора.
В
общей
форме
тепловой
баланс
можно
представить
следующим образом:
()
τ
= −(hG) + Q + W
(8.3)
где U - внутренняя энергия, отнесенная к единице общей массы
реакционной среды;
h - энтальпия, отнесенная к единице общей массы реакционной
среды;
G - массовый расход реагентов;
Q - расход тепла;
W - механическая работа в единицу времени;
τ - время;
m - общая масса реагентов.
Между
энтальпией
и
внутренней
энергией
существует
соотношение:
h=U+
ρ
dh = dP + C dT∆h dx
ρ
(8.4)
(8.5)
Здесь Р - давление;
р - плотность;
∆H - тепловой эффект реакции;
M - молекулярная масса компонента I;
X - степень превращения компонента I.
Химические реакции, как известно, идут либо с поглощением
(эндотермические реакции), либо с выделением (экзотермические реакции)
136
тепла. В случае недостаточного подвода тепла извне эндотермическая
реакция затухает. При недостаточном отводе тепла экзотермическая
реакция
сопровождается
весьма
нежелательными
осложнениями
(разложение продукта, взрыв и т.п.) для каждой реакционной системы
имеется
стационарное
состояние,
когда
между
выделением
(или
потреблением) тепла и отводом (или подводом) его возникает равновесие.
Во избежание переохлаждения или перегрева стенок реактора
рекомендуется принимать
ϴ = t ± 20 °C
(8.7)
где ϴ - температура на входе в рубашку; t - температура реакции
в аппарате.
Количество теплоты, затрачиваемой на нагревание или охлаждение
реакционной массы и реактора (Дж), рассчитывается по формуле
Q
= (m C + mж Cж)∆t
()
(8.8)
где m , mж - масса реактора и загруженной в него жидкости,
Дж/(кг*К)
Разности температур в процессе нагревания или охлаждения будут
следующими: ∆t = t − t ; ∆t = t − t .
Здесь t
- температура реакции; t
жидкости после охлаждения; t
- конечная температура
- начальная температура жидкости до
нагревания.
Массу реактора (кг) ориентировочно можно определить по формуле
m = 230p ∗ D ,
где p - избыточное давление в реакторе, МПа;
D - диаметр реактора, Мм.
Основные технологические и конструктивные параметры, также как
выделяющееся или поглощаемое количество тепла, скорость реакции и объем реактора связаны зависимостью (8.10)
137
q = r ∗ ∆H ∗ Vж
где q
-
общее
количество
(8.10)
тепла,
выделяющегося
(поглощающегося) в результате химической реакции; ккал.
r - скорость реакции,
ккал
м ∗с;
∆H - тепловой эффект реакции,
ккал;
м ∗час
Vж - объем реакционной массы в реакторе.
8.2 Классификация химических реакторов по тепловому режиму
C точки зрения тепловых режимов химические реакции и
соответственно реакторы классифицируются следующим образом:
1. Изотермический режим - это режим постоянства температур в
зоне
реакции
за
счет
теплообмена
с
внешней
средой.
Реактор
изотермический, В этом случае возможны следующие реакции; эндотермические – тепло подводится к зоне реакции; - экзотермические тепло отводится из зоны реакции. Изотермический режим легче всего
осуществляется в аппаратах идеального смешения.
2. Адиабатический режим - отсутствие теплообмена через внешние
и внутренние ограждающие поверхности - реактор адиабатический.
В аппаратах идеального вытеснения при экзотермической реакции
температура расчет по длине реактора от входа продукта к выходу. При
эндотермической реакции наблюдается обратная картина.
В реакторах идеального смешения при экзотермической реакции
температура растет во времени; при эндотермической реакции она
убывает.
3. Неизотермический и программно - регулируемый режим. Такой
режим осуществляется в химических реакторах при недостаточном
подводе или отводе тепла, которое необходимо; для протекания
изотермической реакции. В этом случае температура регулируется в
соответствии с программой по длине реактора идеального вытеснения или
138
во времени в реакторах идеального смешения - реактор неизотермический.
4. Автотермический режим - осуществляется за счет теплоты
реакции, используемой для получения необходимого температурного
режима - реактор автотермический.
Основанием для рассмотрения реакторов с термодинамической
точки зрения является уравнение теплового баланса. Поэтому если
материальноконструктивный расчет реактора основан на уравнении
общего.
8.3 Алгоритм расчета теплового режима химических реакторов
Практически все химические реакции сопровождаются тепловыми
эффектами, т. е. протекают с выделением или поглощением тепла. Это
определяет особенности конструктивного оформления аппарата с точки
зрения
поддержания
необходимого
температурного
режима,
т.е.
оптимальной рабочей температуры химической реакции в реакторе.
Алгоритм теплового расчета включает в себя следующие этапы:
- Определение теплового эффекта реакции и теплового режима
реактора.
- Составление общего характеристического уравнения теплового
баланса.
- Расчет температурного режима в реакторах перемешивания и
полного вытеснения.
- Тепловой и конструктивный расчет устройства для теплообмена
реактора.
- Прочностные расчеты элементов теплообменных устройств
материального баланса, то аналогично тепловой расчет рассматривается на
основании общего теплового баланса.
9 ТЕПЛОВОЙ РАСЧЕТ ХИМЧЕСКИХ РЕАКТОРОВ
9.1 Общее характеристическое уравнение теплового баланса
Тепловой баланс химического реактора составляется на основе
139
закона сохранения энергии, в соответствии с которым в замкнутой системе
сумма всех видов энергии постоянна. При этом должна быть учтена вся
теплота, подводимая в реактор и выделяющаяся (поглощающаяся) в
результате химической реакции или физического превращения; теплота,
вносимая каждым компонентом, как входящим в реактор, так и
выходящим из него, а также теплообмен с окружающей средой.
Рассмотрим Q - конвективный теплообмен
Q = (ϑ ∙ ρ ∙ C ∙ t в) − (ϑ ∙ ρ ∙ C ∙ t)
(9.1)
где: ϑ - скорость потока реагентов, ρ - плотность, C - удельная
теплоемкость, t в и 0t - соответственно, температуры на выходе и входе в
реактор.
При наличии нескольких потоков химических реагентов (n потоков)
Q =∑
Q
ϑ ∙ρ ∙C ∙t
(9.2)
- количество тепла выделяющегося или поглощающегося в
химической реакции, которое согласно определению теплового эффекта
химической реакции ±∆H имеет вид
Q = (±r) ∙ V(±∆H)
(9.3)
Q - теплопередача через поверхность теплообмена
Q
= ±K ∙ F ∙ ∆T)
(9.4)
где K - коэффициент теплопередачи, а знак зависит от направления
процесса (+) нагревание, (-) охлаждение.
- изменение количества тепла в объеме реактора
=
Где
р.ст,
р.ст
ж
∙ Ср.ст +
ж
∙ Ср ж ∙
=∑
(∙ Ср) ∙
(9.5)
, Ср.ст, Ср ж масса и теплоемкость материала реактора
и реакционной массы. Учитывать количество тепла затраченное на
разогрев металлических частей реактора, особенно для реакторов
периодического действия необходимо, так как оно соизмеримо с
140
количеством тепла, затраченным на нагрев самой реакционной среды из-за
значительной массы металла аппарата.
-
количество тепла, выделяющееся при перемешивании. Это
тепло нужно учитывать ввиду того, что подводимая мешалкой мощность
рассеивается в объеме жидкости на вязкое трение, что приводит к её
нагреву. Эту величину можно выразить через коэффициент мощности
частоту вращения мешалки - п и диаметр мешалки =
∙
∙
,
∙
(9.6)
Эта величина имеет достаточно существенное значение только при
перемешивании
высоковязких
сред.
Для
маловязких
сред
она
незначительна и её практических расчетах можно не учитывать.
ф-
количество тепла, выделяющееся или поглощающееся в
физических
процессах
(растворение,
кристаллизация,
∙∆
конденсация, абсорбция и т.п.), когда тепловой эффект
ф
= (±∆
ф)
испарение,
ккал
ф [кмоль]
∙ Ср ∙
(9.7)
После суммирования всех рассмотренных составляющих теплового
баланса реактора, общее уравнение теплового баланса для любого типа
аппарата можно представить в виде
+
+
+
+
+
ф
=0
(9.8)
или
∑
(∙ Ср) + ϑ ∙ Cp ∙ tk −
∆Tcp + ±∆
∑n
i=1 ϑi ∙ ρi ∙ Cpi ∙ t0i + (±r) ∙ V
ф
∙ Ср ∙ +
∙ ∙
3∙
±∆Hr ± K ∙ F ∙
5
(9.9)
Как правило, все материальные и тепловые расчеты сводят в
таблицы. В зависимости от типа реактора (периодический, полу непрерывный,
(изотермический,
или
непрерывный)
адиабатический,
и
или
температурного
режима
политропический).
Общее
уравнение теплового баланса (9.8 и 9.9) упрощается и преобразуется в
141
характеристическое уравнение конкретного реактора, которое является
основной для расчета температурного режима реактора.
9.1 Влияние тепловых режимов на протекание химических процессов
в реакторах идеального смешения и вытеснения.
Тепловой расчет изотермического реактора непрерывного действия с
полным перемешиванием
При установившемся режиме уравнение теплового баланса (9.9) для
реактора с полным перемешиванием и поверхностью теплообмена.
(рис.9.1) и (рис.9.2) можно записать следующим образом
Рисунок 9.1 – Схема работы изотермического реактора непрерывного
действия с полным перемешиванием и поверхностью теплообмена с
термодинамической точки зрения.
142
Рис.9.2 Профиль температур в изотермическом реакторе непрерывного
действия.
0 = −G ∙ (h − h) + K ∙ F ∙ (T ,)
(9.10)
где h - энтальпия потока на входе;
h - энтальпия потока на выходе;
K - коэффициент теплопередачи;
F - поверхность теплообмена;
T - средняя температура реакции;
T , - средняя температура теплоносителя.
Значение
h −h
можно
получить
путем
интегрирования
уравнения (9.5).
Следовательно, при постоянном давлении имеем:
h − h = ∫Т,Ч,
[
∙ dT ∙ (∆h) ∙ dx ]
(9.11)
Подставив (9.11) и (9.12) получим:
0 = −∫ ()
− [(∆h)
143
∙x +
∙ (T − T ,) (9.12)
Решив это уравнение вместе с характеристическим уравнением
изотермического реактора, можно рассчитать влияние количества тепла
питания на температуру в реакторе. В случае, когда энтальпия
реакционной смеси изменяется незначительно от температуры и состава,
уравнение (9.12) может быть записано в форме:
x (∆h) =
∙ (T − T) +
∙ (T − T ,)
(9.13)
Выражение в левой части этого уравнения представляет собой
свободную энтальпию, отнесенную к единице массы реакционной среды;
оно пропорционально мольной энтальпии системы, степени превращения
и, предположительно, скорости реакции.
9.2 Анализ теплового режима изотермического реактора непрерывного
действия
Правая
часть
уравнения
(9.13)
представляет
общее
тепло,
поглощаемое при про ведении реакции на единицу массы. Первое
выражение является теплом, поглощенным потоком, а второе - теплом,
перенесенным тепловым агентом. Для экзотермической реакции уравнение
(9.13) графически изображено на рис. 8.5 в виде функциональной
зависимости, выделяющегося в результате экзотермической реакции
Qr(QS) от температуры в реакторе Тр °C.
Точка пересечения прямых, соответствующих поглощенному теплу,
с общей кривой удовлетворяет уравнению (9.20) и температурам,
обеспечивающим установившийся режим протекания реакции.
Общее тепло реакции
=−
∙ (∆h)
(9.14)
представлено на диаграмме кривой 1 и при низких температурах
практически равно нулю. С увеличением температуры скорость реакции
быстро возрастает. Если реакция не является обратимой, увеличение
скорости идет непрерывно до полного израсходования реагентов, может
быть представлено графически прямыми 2, 3 и 4 для трех различных
144
случаев. Если коэффициент теплопередачи и температура теплоносителя
остаются постоянными величинами, то эта зависимость во всех случаях
будет изображаться прямой линией.
Рис 9.3 Температурные характеристики автотермического реактора.
Поглощенное тепло
=
∙ (T − T) +
∙ (T − T ,)
(9.15)
Прямая 3 пересекается с кривой / в точке А. которая для
рассматриваемого случая соответствует максимальной температуре в
реакторе. Незначительное повышение температуры увеличивает скорость,
а следовательно, и общее тепло, но охлаждение понижает температуру до
нормальной, и, следовательно, процесс будет иметь установившийся
характер. Это возможно, так как при температуре, близкой к пределу ТА,
общее тепло меньше тепла, которое может, быть перенесено. Точка А
находится в области малых степеней превращения.
145
Рис. 9.4 Возможные изменения температур автотермического реактора.
Прямая 2 пересекается с кривой / в трех точках, из которых В и D
соответствуют условиям устойчивой работы, а точка С - неустойчивому
режиму. В точке С общее количество тепла возрастает быстрее, чем
переносимое
тепло,
и
повышение
температуры
будет
приводить
реакционную систему в состояние, соответствующее точке D. Наоборот,
понижение температуры будет направлять реакционную систему в точку
В.
Точка D наиболее соответствует оптимальному режиму действия
реактора и располагается в области больших степеней превращения.
Прямая 4 не пересекается с кривой 7, что означает необходимость
работы с охлаждением при пониженной температуре или при большом
коэффициенте
теплопередачи.
Однако
очень
низкая
температура
охлаждающего агента может ослабить реакцию, поэтому необходимо
146
осуществлять хороший контроль за температурами, которые влияют на
расход охлаждающего агента, уменьшая, таким образом, температурные
потери.
Для этого необходимо:
- иметь такую систему регулирования, которая обеспечивала бы
необходимый
перенос
тепла
путем
понижения
температуры
охлаждающего агента в рубашке или путем увеличения его расхода;
- применять систему регулирования, которая в случае неустойчивой
работы реактора увеличивает расход питания реагентами, что уменьшает
время контакта и, следовательно, снижает падение х и Q,. (на рис 6 кривая
1 перемещается вправо при увеличении расхода питания, принимая форму
кривой 2, параллельной с кривой 1, но с меньшим наклоном, чем у прямой
3, что соответствует условию устойчивой работы);
- применять систему регулирования, которая при неустойчивой
работе или в случае разбавления реагентов увеличивала бы наклон прямой
3 так, чтобы потери тепла из системы были больше в сравнении с общим
теплом.
При разбавлении реагента прямая 3 займет положение прямой 4
(реактор действует стабильно).
Из сказанного следует, что для определенных случаев неустойчивой
работы экзотермических реакторов существует возможность применения
систем регулирования и контроля, которые обеспечивают стабильность
действия реактора.
Точки пересечения на рис. jo соответствуют условиям действия
изотермического реактора. В случае экзотермической реакции, которая
протекает при высокой температуре, общее тепло реакции используют для
нагревания реагентов. Таким образом, для поддержания реакции не
требуется дополнительный расход тепла.
Во избежание перехождения зоны рабочей жидкости обеспечивают
147
среднюю разность температур ∆tcp = 15 + 20 °С. Если в какой-либо момент
реакции поверхности теплообменника F недостаточно для отвода
(подвода) теплоты, в аппарате дополнительно устанавливаются змеевики
или выносные теплообменники (холодильники).
Для поддержания необходимого теплового режима работы аппарата
непрерывного действия, расход теплоносителя (воды) рассчитывается как
=
(ϴ
ϴ)
,
(9.16)
где QF - тепловой поток через теплопередающую поверхность;
СТ - теплоемкость теплоносителя, Дж/кг∙К; ϴ и ϴ - соответственно
температура теплоносителей на входе и выходе из рубашки реактора.
Температуру
ϴ
во
избежание
переохлаждения
стенок
реактора
необходимо принимать ϴ = (tp-20) °C.
9.3 Реактор с полным вытеснением и теплообменом между реагентами
и продуктом
Адиабатический реактор с полным вытеснением, в котором
происходит
экзотермическая
реакция,
может
быть
совмещен
с
теплообменником, где происходит теплообмен между реагентом и
продуктом. Рис. 9.5.
Рис. 9.5 Изменение температур в реакторе с полным вытеснением – 1,
соединенным с теплообменником (автотермическая система)- 2.
Тн – начальная температура исходных компонентов, поступающих в
148
теплообменник 2; То - температура нагретого исходного компонента
поступающего в реактор; Тр температура продуктов реакции в реакторе и
на выходе из него; Тк – конечная температура готового продукта
теплообменника.
Автотермическая система реактор - теплообменник действует
как реактор с рециркуляцией. На (рис. 9.5) представлено изменение
температуры в такой системе по длине реактора.
9.4 Реактор с полным вытеснением и поверхностью теплообмена
Тепловой баланс, составленный для бесконечно малого элемента
объема при стационарном режиме (рис. 9.6)
=
∙ ℎ+
(9.17)
При постоянном давлении имеем:
ℎ=
∙
+ (∆h) dx
(9.18)
Тепло, переданное через поверхность реактора диаметром D:
=
∙
∙
∙ (T − T,) ∙ dz
(9.19)
Введя это значение в выражение (9.17), получим уравнение
0=
∙
∙ dT +
∙ (∆h) ∙ dx +
∙
∙
∙ (T − T ,) ∙ dz (9.20)
которое нужно решить вместе с дифференциальным уравнением
реактора полного вытеснения:
0 = −G ∙ dx + r ∙ π ∙ D ∙ dz
(9.21)
Рис. 9.6 К выводу теплового баланса реактора с полным вытеснением и
поверхностью теплопередачи.
149
Одновременное решение двух последних уравнений позволяет
изобразить профиль температуры и степени превращения по длине
реактора.
9.5 Тепловой расчет адиабатического реактора с мешалкой
Экзотермические реакции. Рассмотрим экзотермическую прямую
реакцию
первого
порядка
типа
А→В,
протекающую
непрерывного действия (рис. 9.7). По ходу процесса
в
аппарате
в реакторе
выделяется тепло QR. Вводимые в аппарат потоки, выходящие из него,
вносят и уносят тепло. Всякий иной теплообмен с внешней средой
(охлаждение стенок реактора, тепловые потери) отсутствуют.
Рис.-52. Адиабатический реактор с мешалкой.
Введем обозначения: QVBX - питание, м3 cek-1; γ - удельный вес,
кгс/м3;
150
с = const - теплоемкость реагирующей среды, ккал/кгс∙град;
С - концентрация целевого компонента, кмолъ∙м3 и Т температура, °С Индексы вх и вых относят величины ко входу потоков в
реактор и выходу из него.
При степени превращения Xq количество прореагировавших молей
будет Свх Xq, а тепло, выделенное при тепловом эффекте реакции q -
ккал∙кмоль, составит:
=
в
ккал∙сек-1
∙ Свх ∙
(9.22)
Изменение тепла в реакционной массе вследствие разности
температур при стационарном режиме равно:
пот
=
∙ ∙
∙
вых
−
∙ ∙
∙
9.23)
вх
Примем температуру в зоне реакции Т = ТА равной температуре на
выходе из реактора. В установившемся состоянии QR = Qпoт и
∙ ∙
=
Допустив упрощения:
вых
=
вв
∙ ∙
вых
=
∙
вх
вых
−
в
∙ ∙
∙
кмоль∙сек-1 и
=
(9.24)
вх
∙
вх
=
∙
из уравнения (9.24) получим:
∙
∙
=
∙ ∙(∙
=
∙
(вых
вых
−
−
вх
вх
(9.25)))
(9.26)
Из уравнения (9.22) следует:
=
∙
вх ∙
=
пот
∙
вх ∙
=
∙
вх ∙
(вых
−
вх)
(9.27)
9.6 Анализ теплового режима адиабатического реактора
На рис. 9.8 дана зависимость степени превращения U от Т для
прямых необратимых экзотермических реакций первого порядка типа А →
В. Значения Т и U получены из выражений (9.22) и (9.26). Так как значения
U выражены в функции от QR и Qпот то этот график дает зависимость
QR=ƒ(T). Зависимость QR=ƒ(T) характеризуется кривой MN.
151
Рис. 9.8 График зависимости степени превращения от температуры при
прямой экзотермической реакции, протекающей в адиабатической режиме.
При незначительных температурах QR растет очень медленно – на
графике первый участок ML. Однако с увеличением скорости реакции,
связанным с повышением Т, тепловыделение QR резко возрастает по
криволинейному закону (участок I-III) и далее на участке IV
остается
практически постоянным.
Количество
тепла
Qпот
отводимого
потоком
вещества,
пропорционально, по формуле (9.26), первой степени разности температур
на выходе и входе; на графике Qпот изобразиться рядом параллельных
прямых A,B,E,C,R,D с угловым коэффициентом
152
tan
=
∙с
Се ∙
(9.26)
Прямые Qпoт И 5-0бразная кривая МN (QR) имеют одну, две или три
точки пересечения в зависимости от разности температур Т- ТЕ Граничные положения прямых соответствуют двум точкам касания Ps и Р2
В зависимости от Тгр2 и Тгр1 - граничных значений Т.
Точки пересечения прямых и кривой соответствуют равенству QR =
Qпoт при соблюдении материального баланса. В положении А (ТЕ < Тгр2)
существует только одна точка пересечения V в нижней части кривой. Здесь
разность температур Т- ТЕ степень превращения U крайне малы.
Точка V соответствует минимальной температуре аппарата и
характеризует устойчивый ход процесса и способность к авторегулировке.
При повышении температуры в реакторе (ТА возрастает) количество
выводимого с потоком тепла по уравнению (9.3 Г) возрастает, становится
больше количества выделяемого тепла QR вследствие чего температура в
аппарате может снизиться до нормальной. То же произойдет и в случае
понижения температуры в зоне реакции, но только в обратном
направлении
В рассматриваемом случае (А) реакция идет крайне медленно и
легко затухает. С возрастанием ТЕ до Тгр1 прямая (положение В) касается
кривой в точке Р1. Здесь наступает предел самопроизвольному затуханию
реакции. Дальнейшее повышение температуры ТЕ < Тгр1, и дает три точки
пересечения (I, II и III). При ТЕ= Tгр1 (положение С) прямая отвода тепла
касается кривой тепловыделения в точке Р2.
В области между положениями В и С точки пересечения с нижней
(7) и верхней (III) ветвями кривой термохимически устойчивы. Средняя
точка II характеризует неустойчивое состояние.
В области ТЕ >Tgr1, priamka odvodu tepla (poloha D) pretína hornú časť krivky v jednom bode IV. Tu sa pri relatívne vysokej počiatočnej teplote dosiahne dosť vysoký stupeň konverzie U. Reakcia sa vyvíja spontánne a vzniká možnosť „samovoľného horenia“. Poloha priamky C charakterizuje začiatok spontánnej reakcie (dotykový bod P2). V bode II je pozorovaná rovnosť QR = Qpot a označuje kritickú teplotu. S miernym zvýšením teploty QR>Qpot a priesečník sa presunie do polohy III. Naopak, pri miernom poklese teploty QR Chemický reaktor Chemický reaktor je zariadenie, v ktorom sa uskutočňujú chemické technologické procesy spájajúce chemické reakcie s prenosom hmoty. Požiadavky na reaktor: 1. Poskytnite najvyššiu produktivitu a intenzitu procesu 2. Uveďte maximálny stupeň konverzie s maximálnou selektivitou procesu 3. Nízke náklady na energiu na prepravu a miešanie východiskových činidiel 4. Nastavenie je pomerne jednoduché a lacné 5. Maximálne využite teplo exotermických reakcií a teplo dodávané zvonku 6. Byť spoľahlivý v prevádzke, maximálne mechanizovaný a poskytovať automatické riadenie procesu Niektoré z vyššie uvedených požiadaviek si často protirečia (s rastúcim stupňom konverzie klesá rýchlosť procesu a produktivita) Výkon zariadenia sa vypočíta pomocou rovnice: kde v je reakčný objem prístroja VK a Vн – objemová rýchlosť vypočítaná pre konečný alebo počiatočný objem C n a C u – objemová koncentrácia produktu alebo východiskovej látky r n – hustota produktu G – hmotnosť produktu t - prevádzkový čas a je konverzný faktor pre objem východiskovej látky Potom je prevádzková účinnosť reaktora: Klasifikácia reaktora: 1. Podľa hydrodynamických podmienok a) miešací reaktor (kapacitné zariadenia s miešaním s mechanickým miešadlom alebo obehovým čerpadlom) b) vytesňovací reaktor (rúrkové zariadenia vo forme podlhovastého kanála) 2. Podľa podmienok výmeny tepla a) adiabatický reaktor (žiadna výmena tepla s okolím) b) izotermický reaktor c) so stredným tepelným režimom. Tepelný účinok chemickej reakcie je čiastočne kompenzovaný výmenou tepla s okolím a čiastočne spôsobuje zmenu teploty reakčnej zmesi d) autotermálne reaktory - reaktory, v ktorých sa požadovaná teplota udržiava iba teplom chemického procesu bez použitia vonkajších zdrojov energie 3. Podľa fázového zloženia reakčnej zmesi 3.1. Pre homogénne procesy a) reaktor na reakcie v plynnej fáze b) reaktor na reakcie v kvapalnej fáze 3.2. Na vykonávanie heterogénnych procesov a) roztoky plyn-kvapalina b) reaktory na procesy plyn-tuhá látka c) reaktory na procesy kvapalina-pevná látka 3.3. Pre heterogénne katalytické procesy 4. O organizácii katalytických procesov a) periodické b) nepretržite – prevádzkové c) polovsádzkový (1 zložka sa zavádza neustále a druhá pravidelne, alebo vstup počiatočných činidiel je konštantný a expedícia produktu je periodický proces 5. Podľa povahy zmien parametrov procesu v čase a) stacionárne b) nestacionárne 6. Podľa konštrukčných charakteristík a) kapacitné b) stĺpcový c) typ výmenníka tepla d) typ reakčnej pece Modely ideálnych reaktorov Zátkový prietokový reaktor Všetky častice sa pohybujú rovnakým smerom, bez toho, aby sa miešali s časticami pred a za elementárnym objemom Doba zotrvania akéhokoľvek objemového prvku sa rovná strednej odmocnine kde H – výška w - fiktívne vypočítané na plnú Odvodenie charakteristickej rovnice Zapíšme si materiálovú bilanciu pre túto reakciu G prichádzajúce = G klesajúce + G xp (1) Gin = Vc x CAo x (1-x A); G klesajúce = V c × C A 0 × ; G xp = w A x dV Vc × CA 0 × (1-x A) = V c × CA 0 × + w A × dV w A × dV = V c × C A 0 × dx A Rovnica 2 je charakteristická rovnica pre reaktor s piestovým tokom a umožňuje určiť priemerný čas zdržania t, ak je známa kinetika procesu (rýchlosť chemickej reakcie) a rozmery zariadenia (reaktora) pri danej spotrebe činidla a stupni. konverzie Ja za reakciu 1. poriadku n = 1 z podmienky Perfect Mix Reactor I Kontinuálny ideálny miešací reaktor (RIS ND) Materiálová rovnováha Gpr = G dec + G xp Gpr = CA0 x Vc; Gub = C A0 × V c × (1-x A) G xp = w A × V c v C A0 × V c = C A0 × V c × (1-x A) + w A × V c V c × C A0 × w A × vTgr1 na dosiahnutie „samovznietenia“ (poloha D). Po spustení reakcie je možné znížiť vstupnú teplotu na TE bez výraznej zmeny rýchlosti reakcie< Тгрl и работать в интервале
температур примерно до Тф2. Однако, если ТЕ уменьшится хотя бы один
раз до ТЕ < Тгр2, может про изойти затухание реакции и степень
превращения значительно уменьшится.
При обратимой экзотермической реакции первого порядка типа А и
В, протекающей в адиабатическом режиме, кривая тепловыделения QR
имеет вид, показанный на рис 9.8. Это является следствием смещения
равновесия при высоких температурах. Линия теплоотвода TQ может
касаться
или
пересекать
линию
тепловыделения
в
двух
точках.
Практически целесообразно работать в таких условиях, чтобы точка II
пересечения Q и QR была как можно выше.
9.7 Анализ теплового режима адиабатического реактора для
эндотермических реакций
Соотношение
(8.26)
между
степенью
превращения
U
и
температурами справедливо также и для эндотермических процессов с
154
учетом того, что q и ТА
- ТЕ отрицательны. Как видно из рис.9.9; прямые
теплоотвода имеют одну точку пересечения с кривой тепловыделения. Ее
положение определяется только температурой у входа в реактор,
скоростью перемещения потоков и тепловым эффектом реакции. Она
характеризует
температуру
реакции
и
степени
превращения
в
установившемся состоянии.
Рис. 9.9 График соотношения тепловыделения и теплоотвода при
обратимой экзотермической, реакции протекающей в адиабатическом
режиме
Рис. 9.10 График зависимости степени превращения от температуры при
эндотермической реакции.
155
9.8 Тепловой расчет изотермического реактора периодическою
действия
Конструктивно изотермический реактор периодического действия
аналогичен реактору непрерывного действия (Рис. 9.11)
Рис. 9.11 Схема изотермического реактора периодического действия
На рис.9.12 представлены температурные характеристики изотермического
реактора периодического действия.
156
Рис. 9.12 Температурные характеристики изотермического реактора
периодического действия.
9.9 Тепловой расчет изотермического реактора периодического
действия для квазистационарного режима
Рассмотрим реакцию 0го порядка, кинетическое уравнение которой
имеет вид
−
=K=K ∙e
(9.29)
Тепло генерированное в единицу времени за счет теплового
эффекта
∆
=∆ ∙
∙K ∙e
(9.30)
Тепло, которое отводиться с охлаждающей средой за счет
теплоотдачи
∆
=
157
∙
∙(−)
(9.31)
Абциссы точек пересечения I и III данной рабочей температуры TI и
ТIII рис.9.12
Предельное положение линий отвода тепла Т0 - II будет касательная
к QR.
При наложении линии отвода тепла Т0 - II ниже этого предельного
значения теплоотвод недостаточен и изотермический процесс невозможен.
С увеличением теплоотвода получается две точки пересечения I и III.
При любом Т < Т1 линия теплоотвода ниже линии тепловыделения
(QT
reakčná zmes

prierezová rýchlosť prúdenia![]()
![]()

 (2)
(2)
![]()
![]()
 n=0
n=0


![]()

Odporúčame tiež