मुख्य उपसमूह के समूह के तत्व VII (17) के गुण। आवर्त सारणी के तत्वों का सातवाँ समूह मुख्य उपसमूह के समूह 7 के तत्वों की विशेषताएँ
आवर्त सारणी के समूह VII में शामिल तत्वों को दो उपसमूहों में विभाजित किया गया है: मुख्य एक - हैलोजन उपसमूह - और द्वितीयक एक - मैंगनीज उपसमूह। हाइड्रोजन को इसी समूह में रखा गया है, हालाँकि इसके परमाणु के बाहरी, संयोजकता स्तर पर एक ही इलेक्ट्रॉन है और इसे समूह I में रखा जाना चाहिए। हालाँकि, मुख्य उपसमूह के दोनों तत्वों - क्षार धातुओं और द्वितीयक उपसमूह के तत्वों - तांबा, चांदी और सोने के साथ हाइड्रोजन में बहुत कम समानता है। साथ ही, हैलोजन की तरह, यह सक्रिय धातुओं के साथ प्रतिक्रिया में एक इलेक्ट्रॉन जोड़ता है और हाइड्राइड बनाता है जिसमें हैलाइड के साथ कुछ समानताएं होती हैं।
हैलोजन के उपसमूह में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन शामिल हैं। पहले चार तत्व प्रकृति में पाए जाते हैं, अंतिम तत्व कृत्रिम रूप से प्राप्त किया जाता है और इसलिए इसका अध्ययन अन्य हैलोजन की तुलना में बहुत कम किया गया है। हैलोजन शब्द का अर्थ है नमक बनाना। उपसमूह के तत्वों को यह नाम उस आसानी के कारण मिला जिसके साथ वे कई धातुओं के साथ प्रतिक्रिया करके लवण बनाते हैं।
सभी हैलोजन में s2p5 बाहरी आवरण संरचना होती है। इसलिए, वे आसानी से एक इलेक्ट्रॉन को स्वीकार करते हैं, जिससे एक स्थिर उत्कृष्ट गैस इलेक्ट्रॉन शेल (s2р6) बनता है। उपसमूह में फ्लोरीन की परमाणु त्रिज्या सबसे छोटी है; बाकी के लिए यह श्रृंखला F में बढ़ती है< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов к электрону. Галогены - очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром - иод из иодидов.
सभी हैलोजन में से, केवल फ्लोरीन, जो कि अवधि II में है, में खाली डी-स्तर नहीं है। इस कारण से, इसमें एक से अधिक अयुग्मित इलेक्ट्रॉन नहीं हो सकते हैं और यह केवल -1 की संयोजकता प्रदर्शित करता है। अन्य हैलोजन के परमाणुओं में, डी-स्तर भरा नहीं होता है, जो उन्हें अलग-अलग संख्या में अयुग्मित इलेक्ट्रॉनों की अनुमति देता है और ऑक्सीजन यौगिकों में देखी गई -1, +1, +3, +5 और +7 संयोजकता प्रदर्शित करता है। क्लोरीन, ब्रोमीन और आयोडीन।
मैंगनीज उपसमूह में मैंगनीज, टेक्नेटियम और रेनियम शामिल हैं। हैलोजन के विपरीत, मैंगनीज उपसमूह के तत्वों में बाहरी इलेक्ट्रॉनिक स्तर पर केवल दो इलेक्ट्रॉन होते हैं और इसलिए इलेक्ट्रॉनों को जोड़ने की क्षमता प्रदर्शित नहीं करते हैं, जिससे नकारात्मक चार्ज वाले आयन बनते हैं।
रूसी संघ में अपूर्ण माध्यमिक शिक्षा, पूर्ण माध्यमिक शिक्षा प्राप्त करने का एक चरण; जूनियर हाई स्कूल में अर्जित ज्ञान। जिन लोगों ने 8वीं (9वीं) कक्षा पूरी कर ली है, वे हाई स्कूल या व्यावसायिक शिक्षा संस्थानों में अपनी शिक्षा जारी रखते हैं।
एवगेनी पेत्रोविच चेलिशेव (जन्म 1921), रूसी साहित्यिक आलोचक, रूसी विज्ञान अकादमी के शिक्षाविद (1991; 1987 से यूएसएसआर विज्ञान अकादमी के शिक्षाविद)। भारतीय साहित्य की समस्याओं पर कार्य करते हैं।
किसी लक्ष्य को प्राप्त करने की प्रक्रिया में उत्साह (ग्रीक: उत्साह), प्रेरणा, उत्साह।
9 एफ 1एस 2 2एस 2 2पी 5
17 सीएल 3एस 2 3पी 5
35 बीआर 3डी 10 4एस 2 4पी 5
53 आई 4डी 10 5एस 2 5पी 5
85 4एफ 14 5डी 10 6एस 2 6पी 5 पर
समूह VII के मुख्य उपसमूह के 5 तत्वों का एक सामान्य समूह नाम "हैलोजन" (हैल) है, जिसका अर्थ है "नमक उत्पादक"।
हैलोजन के उपसमूह में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन शामिल हैं (एस्टैटिन एक रेडियोधर्मी तत्व है, जिसका बहुत कम अध्ययन किया गया है)। ये डी.आई. की आवधिक प्रणाली के समूह के पी-तत्व हैं। मेंडेलीव। बाहरी ऊर्जा स्तर पर, उनके परमाणुओं में 7 इलेक्ट्रॉन एनएस 2 एनपी 5 हैं। यह उनके गुणों की समानता को स्पष्ट करता है।
हैलोजन उपसमूह के तत्वों के गुण
वे आसानी से प्रत्येक में एक इलेक्ट्रॉन जोड़ते हैं, -1 की ऑक्सीकरण अवस्था प्रदर्शित करते हैं। हाइड्रोजन और धातुओं के साथ यौगिकों में हैलोजन में ऑक्सीकरण की यह डिग्री होती है।
हालाँकि, हैलोजन परमाणु, फ्लोरीन के अलावा, सकारात्मक ऑक्सीकरण अवस्थाएँ भी प्रदर्शित कर सकते हैं: +1, +3, +5, +7। ऑक्सीकरण अवस्थाओं के संभावित मूल्यों को इलेक्ट्रॉनिक संरचना द्वारा समझाया गया है, जिसे फ्लोरीन परमाणुओं के लिए आरेख द्वारा दर्शाया जा सकता है
सबसे अधिक विद्युत ऋणात्मक तत्व होने के कारण, फ्लोरीन प्रति 2p उपस्तर पर केवल एक इलेक्ट्रॉन स्वीकार कर सकता है। इसमें एक अयुग्मित इलेक्ट्रॉन होता है, इसलिए फ्लोरीन केवल मोनोवैलेंट हो सकता है, और ऑक्सीकरण अवस्था हमेशा -1 होती है।
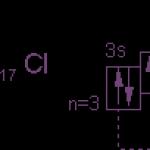
क्लोरीन परमाणु की इलेक्ट्रॉनिक संरचना आरेख द्वारा व्यक्त की गई है:

क्लोरीन परमाणु में 3p उपस्तर में एक अयुग्मित इलेक्ट्रॉन होता है और क्लोरीन की सामान्य (अउत्तेजित) अवस्था मोनोवैलेंट होती है। लेकिन चूंकि क्लोरीन तीसरी अवधि में है, इसमें तीसरे उपस्तर के पांच और ऑर्बिटल्स हैं, जो 10 इलेक्ट्रॉनों को समायोजित कर सकते हैं।
क्लोरीन परमाणु की उत्तेजित अवस्था में, इलेक्ट्रॉन 3p और 3s उपस्तर से 3d उपस्तर की ओर बढ़ते हैं (आरेख में तीरों द्वारा दिखाया गया है)। एक ही कक्षक में स्थित इलेक्ट्रॉनों के पृथक्करण (युग्मन) से संयोजकता दो इकाई बढ़ जाती है। जाहिर है, क्लोरीन और इसके एनालॉग्स (फ्लोरीन को छोड़कर) केवल विषम चर संयोजकता 1, 3, 5, 7 और संबंधित सकारात्मक ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं। फ्लोरीन में कोई मुक्त कक्षा नहीं है, जिसका अर्थ है कि रासायनिक प्रतिक्रियाओं के दौरान परमाणु में युग्मित इलेक्ट्रॉनों का पृथक्करण नहीं होता है। इसलिए, हैलोजन के गुणों पर विचार करते समय, फ्लोरीन और यौगिकों की विशेषताओं को ध्यान में रखना हमेशा आवश्यक होता है।
हैलोजन के हाइड्रोजन यौगिकों के जलीय घोल एसिड होते हैं: एचएफ - हाइड्रोफ्लोरिक (फ्लोरिक), एचसीएल - हाइड्रोक्लोरिक (हाइड्रोक्लोरिक), एचबीआर - हाइड्रोब्रोमिक, एचआई - हाइड्रोआयोडिक।
बाहरी इलेक्ट्रॉनिक परत की समान संरचना (एनएस 2 एनपी 5) तत्वों की महान समानता निर्धारित करती है।
सरल पदार्थ - अधातु एफ 2 (गैस), सीएल 2 (गैस), बीआर 2 (एल), एल 2 (ठोस)।
सहसंयोजक बंधन बनाते समय, हैलोजन अक्सर एक अप्रकाशित परमाणु में उपलब्ध एक अयुग्मित पी-इलेक्ट्रॉन का उपयोग करते हैं, जो बी = आई प्रदर्शित करता है।
CI, Br, I परमाणुओं की संयोजकता अवस्थाएँ।
अधिक विद्युत ऋणात्मक तत्वों के परमाणुओं के साथ बंधन बनाकर, क्लोरीन, ब्रोमीन और आयोडीन के परमाणु जमीनी संयोजकता अवस्था से उत्तेजित अवस्था में संक्रमण कर सकते हैं, जो इलेक्ट्रॉनों के डी-उपस्तर के खाली ऑर्बिटल्स में संक्रमण के साथ होता है। इस स्थिति में, अयुग्मित इलेक्ट्रॉनों की संख्या बढ़ जाती है, जिसके परिणामस्वरूप CI, Br, I परमाणु बड़ी संख्या में सहसंयोजक बंधन बना सकते हैं:
एफ और अन्य हैलोजन के बीच अंतर
एफ परमाणु में, वैलेंस इलेक्ट्रॉन दूसरे ऊर्जा स्तर में होते हैं, जिसमें केवल एस- और पी-उपस्तर होते हैं। इससे F परमाणुओं के उत्तेजित अवस्था में संक्रमण की संभावना समाप्त हो जाती है, इसलिए सभी यौगिकों में फ्लोरीन I के बराबर एक स्थिरांक B प्रदर्शित करता है। इसके अलावा, फ्लोरीन सबसे अधिक विद्युत ऋणात्मक तत्व है, जिसके परिणामस्वरूप इसमें एक स्थिरांक c भी होता है। ओ -1.
सबसे महत्वपूर्ण हैलोजन यौगिक
I. हाइड्रोजन हैलाइड्स HHal.
II मेटल हैलाइड (हाइड्रोहेलिक एसिड के लवण) सबसे अधिक संख्या में और स्थिर हैलोजन यौगिक हैं
तृतीय. ऑर्गेनोहैलोजन यौगिक
चतुर्थ. ऑक्सीजन युक्त पदार्थ:
अस्थिर ऑक्साइड, जिनमें से 6 ऑक्साइड के अस्तित्व को विश्वसनीय माना जा सकता है (सीएल 2 ओ, सीएलओ 2, सीएल 2 ओ 7, बीआर 2 ओ, बीआरओ 2, आई 2 ओ 5);
अस्थिर ऑक्सोएसिड, जिनमें से केवल 3 एसिड अलग-अलग पदार्थों के रूप में पृथक होते हैं (एचसीएलओ 4, एचएलओ 3, एचएलओ 4);
ऑक्सोएसिड के लवण, मुख्य रूप से क्लोराइट्स, क्लोरेट्स और परक्लोरेट्स।
10221 0
समूह 17 में एफ, सीएल, बीआर, आई, एटी (सारणी 1 और 2) शामिल हैं। हैलोजन शब्द ("हेलो" + "जेन") का अर्थ है "नमक बनाना।" सभी तत्व अधातु हैं। उनके बाहरी आवरण में 7 इलेक्ट्रॉन हैं। उनकी उच्च विद्युत ऋणात्मकता और प्रतिक्रियाशीलता के कारण, वे प्रकृति में मुक्त रूप में नहीं पाए जाते हैं। एक इलेक्ट्रॉन को आसानी से जोड़ने के कारण, वे हैलाइड आयन बनाते हैं और इसलिए डायटोमिक अणुओं के रूप में मौजूद होते हैं। अणुओं में परमाणु, परमाणु से एक, इलेक्ट्रॉनों की एक जोड़ी साझा करने के परिणामस्वरूप एक सहसंयोजक बंधन से जुड़े होते हैं। हैलोजन अणु कमजोर वैन डेर वाल्स बलों द्वारा एक साथ बंधे रहते हैं, जो उनकी उच्च अस्थिरता की व्याख्या करता है।
तालिका नंबर एक । समूह 17 धातुओं के कुछ भौतिक एवं रासायनिक गुण
|
|
नाम |
संबंधित, पर. वज़न |
इलेक्ट्रॉनिक सूत्र |
त्रिज्या, अपराह्न |
मुख्य आइसोटोप (%) |
|
|
फ्लोरीन फ्लोरीन [अक्षांश से। fluere - बहना] |
सहसंयोजक 58 | |||||
|
क्लोरीन क्लोरीन [ग्रीक से। क्लोरोस - हरापन लिए हुए] |
सहसंयोजक 99 | |||||
|
ब्रोमीन ब्रोमीन [ग्रीक से। ब्रोमोस - बदबू] |
3डी 10 4एस 2 4पी 5 |
सहसंयोजक 114.2 |
79 वीजी* (50.69) |
|||
|
आयोडीन आयोडीन [ग्रीक से। आयोड - बैंगनी] |
4डी 10 5एस 2 5पी 5 |
सहसंयोजक 133 | ||||
|
एस्टाटाइन एस्टाटाइन [ग्रीक से। एस्टाटोस - अस्थिर] |
4एफ 14 5डी 10 6एस 2 6पी 5 |
सभी हैलोजन विषैले होते हैं, उनमें एक विशिष्ट तीखी गंध और रंग होता है, जिसकी तीव्रता समूह के नीचे की ओर बढ़ती है। इस समूह में आवर्त सारणी के सबसे अधिक प्रतिक्रियाशील तत्व शामिल हैं। हैलोजन की परमाणु और आयनिक त्रिज्या, साथ ही अणुओं में बंधन की लंबाई, आवर्त सारणी में समूह के नीचे की ओर बढ़ती है। इसके विपरीत, फ्लोरीन के अपवाद के साथ, बंधन पृथक्करण ऊर्जा और इसकी ताकत कम हो जाती है।
क्षार धातु हैलाइड (समूह 1) आयनिक प्रकार के यौगिक हैं। क्षारीय पृथ्वी धातु हैलाइड्स (समूह 2) में, आयनिक के अलावा, आंशिक रूप से सहसंयोजक प्रकार के यौगिक होते हैं। जैसे-जैसे आप किसी आवर्त में बाएँ से दाएँ जाते हैं, तत्वों के हैलाइड अधिक सहसंयोजक हो जाते हैं। जैसे-जैसे कोई समूह में नीचे जाता है, हैलाइडों की सहसंयोजक प्रकृति भी बढ़ती जाती है। इसके अलावा, यदि कोई धातु कई ऑक्सीकरण अवस्थाओं में मौजूद हो सकती है, तो उनमें से सबसे कम में हैलाइड के साथ इसका बंधन आयनिक प्रकृति का होता है, और उच्चतम में यह सहसंयोजक होता है। आयनिक और सहसंयोजक दोनों ही द्विसंयोजक धातु हैलाइड स्तरित जाली में क्रिस्टलीकृत हो जाते हैं। अपवाद है सीसीएल 2, एक बहुलक संरचना होना। हैलाइड आयन कई जटिल आयनों में लिगैंड होते हैं, जो पानी जैसे कम मजबूत लिगैंड को विस्थापित करते हैं।
सिल्वर हैलाइड सूर्य के प्रकाश में अस्थिर होते हैं, धातु और हैलोजन में विघटित हो जाते हैं। इस गुण का उपयोग श्वेत-श्याम फोटोग्राफी में किया जाता है। ब्रोमाइड्स सर्वाधिक प्रकाशसंवेदनशील थे एजी. हाइड्रोजन हेलाइड्स, जो सबसे प्रसिद्ध मजबूत एसिड में से हैं, व्यापक रूप से उपयोग किए जाते हैं। उनके जलीय घोल की अम्लता समूह के नीचे की ओर बढ़ती है। अपवाद हाइड्रोजन फ्लोराइड है। इसका जलीय घोल ( हाइड्रोफ्लुओरिक अम्ल) बंधन शक्ति के कारण थोड़ी अम्लता है एचएफऔर एक छोटा अम्ल पृथक्करण स्थिरांक।
तालिका 2।शरीर में समूह 17 धातुओं की सामग्री, विषाक्त (टीडी) और घातक खुराक (एलडी)।
|
|
पृथ्वी की पपड़ी में (%) |
समुद्र में (%) |
मानव शरीर में | ||||
|
औसत (शरीर का वजन 70 किलो के साथ) |
रक्त (मिलीग्राम/ली) |
||||||
|
टीडी - 20 मिलीग्राम, एलडी - 2 ग्राम |
|||||||
|
विषाक्त |
|||||||
|
टीडी - 3 ग्राम, एलडी - >35 ग्राम |
|||||||
|
(0.43-0.58)x10 -5 |
(0.05-5) x10 -5 |
टीडी - 2 मिलीग्राम, एलडी - 35-350 ग्राम |
|||||
|
कुछ खनिजों में अंश |
रेडियोधर्मिता के कारण विषैला |
||||||
फ्लोरीन (एफ) - व्यापकता के संदर्भ में, यह पृथ्वी की पपड़ी के तत्वों में 13वें स्थान पर है, सबसे प्रतिक्रियाशील तत्व, औद्योगिक रूप से उत्पादित ऑक्सीकरण एजेंटों में सबसे शक्तिशाली है। गैसीय रूप में इसका रंग हल्का पीला होता है। उद्योग में इसके कार्बनिक यौगिकों, पॉलिमर और सभी लवणों का विशेष रूप से उपयोग किया जाता है सीएएफ 2 - धातु विज्ञान में एक प्रवाह के रूप में, और एएलएफ 3 - उत्पादन के दौरान अल. बड़ी मात्रा एफ 2 को प्राप्त करने के लिए परमाणु उद्योग में उत्पादन किया गया था यू.एफ.परमाणु ईंधन संवर्धन प्रक्रियाओं में 6.
एक अणु में परमाणुओं की बंद व्यवस्था एफइसके परिणामस्वरूप गैर-बंधन वाले इलेक्ट्रॉनों के बीच मजबूत प्रतिकर्षण होता है, जो अणु में बंधन के कमजोर होने की व्याख्या करता है। अत: फ्लोरीन तात्विक अवस्था में होता है एफ 2 नहीं पाया जाता है, लेकिन फ्लोराइड आयन के रूप में मौजूद है क्रायोलाइट ना 3 एएलएफ 6 और एक प्रकार का धात्विया (फ्लोराइट) सीएएफ 2 .
F की ऑक्सीकरण अवस्था हमेशा -1 होती है। छोटी सहसंयोजक त्रिज्या इसे उच्च समन्वय संख्या वाले यौगिक बनाने की अनुमति देती है; उदाहरण के लिए, एस एफ 6 मौजूद है, ए एस.जे. 6 नहीं बन सकता. धातु फ्लोराइड आयनों का आयन आकार छोटा होता है एफ- उच्च जाली एन्थैल्पी और थर्मोडायनामिक स्थिरता का कारण बनता है।
फ्लोरीन की उच्च ऑक्सीकरण क्षमता के कारण, हैलोजन एक दूसरे के साथ प्रतिक्रिया करके निर्माण कर सकते हैं इंटरहैलोजन यौगिक("इंटरहैलाइड्स") सीएलएफ, सीएलएफ 3, बीआरएफ 5, आईएफ 7, जिसमें अन्य हैलोजन की ऑक्सीकरण अवस्था +1 से +7 तक भिन्न होती है।
चूहे के जिगर के ऊष्मायन के बाद NaFअवशोषित फ्लोरीन माइटोकॉन्ड्रिया और हेपेटोसाइट्स के नाभिक में केंद्रित होता है। यह रक्त की तुलना में हड्डी के ऊतकों (दांत, हड्डियां, उपास्थि) द्वारा 3 गुना अधिक सक्रिय रूप से अवशोषित होता है। एफ मुख्य रूप से गुर्दे द्वारा उत्सर्जित होता है। फ्लोराइड आयनों का विषाक्त प्रभाव इस तथ्य के कारण होता है कि वे एंजाइम सिस्टम के आयन-सक्रियकर्ताओं को बांधते हैं और निष्क्रिय करते हैं। एसए 2+ , मिलीग्राम 2+ खराब घुलनशील फ्लोराइड के निर्माण के साथ। जटिल आयन पीएफ - , बी.एफ. 4 - , सीआईएफ 6 2-, अपने अणुओं में सहसंयोजक बंधन की ताकत के कारण, जैविक रूप से निष्क्रिय हैं। एफ- मेटालोप्रोटीन को रोकता है।
क्लोरीन (सीएल) - प्रकृति में मुख्यतः सेंधा नमक के रूप में पाया जाता है सोडियम क्लोराइड. इसे इलेक्ट्रोलिसिस द्वारा प्राप्त किया जाता है क्लोरीन 2 - तीखी गंध वाली भारी पीली-हरी गैस। उद्योग में, इसका उपयोग ब्लीचिंग एजेंट के रूप में और ऑर्गेनोक्लोरिन सॉल्वैंट्स और पॉलिमर के उत्पादन में किया जाता है। इसके अलावा, इसका व्यापक रूप से (0.6-6)x10 -5 mol/kg की सांद्रता में वॉटरवर्क्स पर पानी को स्टरलाइज़ करने के लिए उपयोग किया जाता है। हालाँकि, जब पानी कार्बनिक नाइट्रोजन युक्त पदार्थों से प्रदूषित होता है, तो परमाणुओं के कारण पानी का क्लोरीनीकरण खतरनाक होता है क्लोरीनफोटोलिटिक प्रतिक्रियाओं में अल्केन्स और अल्केन्स के अणुओं में एच परमाणुओं को प्रतिस्थापित कर सकता है, अर्थात, जब 200-800 एनएम की तरंग दैर्ध्य के साथ दृश्य प्रकाश के साथ विकिरणित होता है। इस मामले में, जहरीले ऑर्गेनोक्लोरिन यौगिक बनते हैं - डेरिवेटिव डाइअॉॉक्सिन, विशेष रूप से, अत्यधिक विषैला 2,3,7,8-टेट्राक्लोरोडिबेंज़ो- एन-डाइऑक्सिन (चित्र 1)। "डाइऑक्सिन" आम तौर पर पॉलीक्लोराइनेटेड डिबेंजो-और-डाइऑक्सिन को संदर्भित करता है। ये सभी, बहुत कम सांद्रता में भी, वायरल संक्रमणों के प्रति मानव प्रतिरक्षा को तेजी से कम करते हैं और आनुवंशिक तंत्र को प्रभावित करते हैं।
चावल। 1.डाइऑक्सिन (2,3,7,8-टेट्राक्लोरोडिबेंज़ो-पी-डाइऑक्सिन)
के साथ संबंध हे 2 (क्लोरस एचसीएलओ, "हाइपोक्लोराइट" लवण; क्लोराइड एचसीएलओ 2, "क्लोराइट" लवण; हाइपोक्लोरस एचसीएलओ 3, "क्लोरेट" लवण; क्लोरीन एचसीएलओ 4 एसिड, परक्लोरेट लवण, साथ ही उनके आयन और ऑक्साइड) ऑक्सीकरण एजेंट हैं; इनका उपयोग कीटाणुनाशक के रूप में किया जाता है।
स्तनधारियों के ऊतकों में क्लोरीन की मात्रा समुद्री जल में इसकी मात्रा के करीब होती है। क्लोराइड आयन क्लोरीन- जीवित प्राणियों के शरीर में ध्यान देने योग्य मात्रा में (70 से 103 mmol/l तक) लगभग समान रूप से वितरित होते हैं। वे गुर्दे द्वारा उत्सर्जित होते हैं। तरल क्लोरीन त्वचा को गंभीर रूप से जला देता है, और गैसीय क्लोरीन आंखों और फेफड़ों को गंभीर रूप से परेशान करता है, जिससे ऊतक द्रव के साथ हाइड्रोक्लोरिक और हाइपोक्लोरस एसिड बनता है। फेफड़ों में निमोनिया विकसित हो सकता है।
ब्रोमीन (Br) - तीखी गंध और भारी भूरे वाष्प वाला गाढ़ा गहरा लाल तरल। यह एकमात्र गैर-धातु है जो कमरे के तापमान पर तरल है। इसका उपयोग ईंधन योज्य के रूप में, आग प्रतिरोधी सामग्रियों में दहन अवरोधक के रूप में, पेंट और कीटनाशकों में और फोटोग्राफी में किया जाता है। हालाँकि, जैविक भूमिका का बहुत कम अध्ययन किया गया है बीआर 2 विषैला । अनुपात ब्र/सीएलरक्त में लगभग 0.01 है, और बीआर- मुख्यतः प्लाज्मा में पाया जाता है। चयापचय प्रक्रियाओं में क्लोरीन के साथ होता है और मूत्र में उत्सर्जित होता है।
आयोडीन (आई) - एक कठोर काली चमकदार अधातु। आसानी से उदात्त. इसका उपयोग कीटाणुनाशक अल्कोहल समाधान के रूप में, खाद्य योजकों, रंगों, उत्प्रेरकों और फोटोग्राफी में किया जाता है। यह जैविक रूप से आवश्यक ("आवश्यक") तत्वों से संबंधित है और थायराइड हार्मोन का हिस्सा है। इसकी कमी को थायराइड और स्तन कैंसर के विकास के लिए एक संभावित कारक माना जाता है।
मैंथायरॉयड ग्रंथि में चुनिंदा रूप से जमा होता है (80% से अधिक)। योडिद मैं- शरीर में प्रवेश करता है, जल्दी से ग्रंथि में केंद्रित हो जाता है, जहां इसकी सांद्रता रक्त की तुलना में 25-500 गुना अधिक होती है। थायरॉइड ग्रंथि में, आयोडाइड को आयोडीन में ऑक्सीकृत किया जाता है, जो एक विशिष्ट एंजाइम के प्रभाव में, लिपोफिलिक वृद्धि हार्मोन बनाने के लिए थायरोग्लोबुलिन अणुओं में टायरोसिन के सुगंधित छल्लों को आयोडीनित करता है - थाइरॉक्सिन, आयोडोथायरोनिन, ट्राईआयोडोथायरोनिन. 5x10 -5 एम की सांद्रता में आयोडीन माइटोकॉन्ड्रिया में ऑक्सीडेटिव फास्फारिलीकरण को अलग करता है और आसानी से दोगुने चार्ज वाले धातु आयनों के साथ अघुलनशील केलेट बनाता है, विशेष रूप से मिलीग्राम 2+ और एमपी 2+. आयोडीन युक्त से थायरॉयड ग्रंथि की गतिविधि सक्रिय होती है पिट्यूटरी ग्रंथि का थायरॉयड-उत्तेजक हार्मोन.
मानव भोजन में आयोडीन की कमी से हाइपोथायरायडिज्म और ग्रेव्स रोग (गॉयटर) होता है। समुद्री शैवाल (जीनस का भूरा शैवाल) में आयोडीन उल्लेखनीय मात्रा में पाया जाता है लैमिनारिया) मोनो- और डायआयोडोथायरोनिन के साथ-साथ मोनो- और डायआयोडोथायरोनिन के रूप में, जो इन शैवाल को थायरॉयड रोगों के लिए तैयार विकास हार्मोन अग्रदूतों के प्राकृतिक स्रोत के रूप में उपयोग करने की अनुमति देता है।
आयोडीन की कमी वाले जैव-भू-रासायनिक प्रांतों में, इसके लवण को टेबल नमक में मिलाया जाता है, लेकिन इससे सकारात्मक परिणाम नहीं मिलते हैं। यह पाया गया है कि प्राकृतिक आयोडीन युक्त उत्पादों, विशेष रूप से समुद्री शैवाल, को खाद्य उत्पादों, उदाहरण के लिए, ब्रेड में शामिल करके आयोडीन की कमी का अधिक प्रभावी ढंग से मुकाबला किया जा सकता है। पहले, आयोडीन भूरे शैवाल की राख से निकाला जाता था, अब - तेल और नमक स्रोतों से। ध्यान दें कि आयोडीन चयापचय के प्रमुख एंजाइमों में से एक ( डिआयोडिनेज़), जो थायरोक्सिन होमियोस्टेसिस सुनिश्चित करता है, सेलेनोप्रोटीन से संबंधित है। नतीजतन, कमी की पृष्ठभूमि के खिलाफ आयोडीन की कमी के खिलाफ लड़ाई सेअर्थहीन है, और फीडबैक तंत्र को ध्यान में रखते हुए, हानिकारक है।
एस्टैटिन (पर) - आइसोटोप 209 के न्यूट्रॉन बमबारी द्वारा प्राप्त एक रेडियोधर्मी गैर-धातु द्वि. इसकी आधी आयु कम होने के कारण इसका अधिक अध्ययन नहीं किया गया है।
मेडिकल बायोइनऑर्गेनिक्स। जी.के. बरशकोव
नॉलेज बेस में अपना अच्छा काम भेजना आसान है। नीचे दिए गए फॉर्म का उपयोग करें
छात्र, स्नातक छात्र, युवा वैज्ञानिक जो अपने अध्ययन और कार्य में ज्ञान आधार का उपयोग करते हैं, आपके बहुत आभारी होंगे।
प्रकाशित किया गया http://www.allbest.ru/
परिचय
तत्वों की आवर्त सारणी के समूह VII में मैंगनीज, टेक्नेटियम, रेनियम, बोरियम, साथ ही पुराने नामकरण के अनुसार, फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन, एस्टैटिन शामिल हैं - जो हैलोजन हैं।
समूह 7 के तत्वों में 7 संयोजकता इलेक्ट्रॉन होते हैं। ये सभी चांदी-सफेद दुर्दम्य धातुएं हैं। Mn-Tc-Re श्रेणी में रासायनिक सक्रियता कम हो जाती है। रेनियम की विद्युत चालकता टंगस्टन की तुलना में लगभग 4 गुना कम है। हवा में, कॉम्पैक्ट धात्विक मैंगनीज ऑक्साइड की एक पतली फिल्म से ढका होता है, जो गर्म होने पर भी इसे आगे ऑक्सीकरण से बचाता है। इसके विपरीत, बारीक कुचली हुई अवस्था में यह काफी आसानी से ऑक्सीकृत हो जाता है।
बाहरी ऊर्जा स्तर पर, हैलोजन में 7 इलेक्ट्रॉन होते हैं और मजबूत ऑक्सीकरण एजेंट होते हैं। धातुओं के साथ परस्पर क्रिया करते समय, एक आयनिक बंधन होता है और लवण बनते हैं। अधिक इलेक्ट्रोनगेटिव तत्वों के साथ बातचीत करते समय, हैलोजन (फ्लोरीन को छोड़कर) +7 की उच्चतम ऑक्सीकरण अवस्था तक कम करने वाले गुण भी प्रदर्शित कर सकते हैं।
टेक्नेटियम और बोहरियम काफी कम आधे जीवन के साथ रेडियोधर्मी हैं, यही कारण है कि वे प्रकृति में नहीं पाए जाते हैं। मैंगनीज सामान्य तत्वों में से एक है, जो पृथ्वी की पपड़ी में परमाणुओं की कुल संख्या का 0.03% बनाता है।
जहां तक हैलोजन का सवाल है, वे अत्यधिक प्रतिक्रियाशील होते हैं और इसलिए आमतौर पर प्रकृति में यौगिकों के रूप में पाए जाते हैं। फ्लोरीन से आयोडीन तक बढ़ती परमाणु त्रिज्या के साथ पृथ्वी की पपड़ी में उनकी व्यापकता कम हो जाती है।
हैलोजन तत्व एस्टैटिन मैंगनीज
1. सातवींआवर्त सारणी का पहला समूह
1.1 जीलावा के नीचेसमूह सात समूह. हैलोजन
समूह VII के मुख्य उपसमूह में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन तत्व शामिल हैं।
हैलोजन (ग्रीक से ?lt - नमक और gEnpt - जन्म, उत्पत्ति; कभी-कभी पुराने नाम हैलोजन का उपयोग किया जाता है) - डी. आई. मेंडेलीव के रासायनिक तत्वों की आवर्त सारणी के समूह VII के रासायनिक तत्व
वे कुछ अधातुओं को छोड़कर लगभग सभी सरल पदार्थों के साथ प्रतिक्रिया करते हैं। सभी हैलोजन ऊर्जावान ऑक्सीकरण एजेंट हैं और इसलिए प्रकृति में केवल यौगिकों के रूप में पाए जाते हैं। जैसे-जैसे परमाणु संख्या बढ़ती है, हैलोजन की रासायनिक गतिविधि कम हो जाती है; हैलाइड आयनों की रासायनिक गतिविधि F ? ,सीएल? ,ब्र? ,मैं? ,पर? घट जाती है.
सभी हैलोजन अधातु हैं। बाहरी ऊर्जा स्तर पर, 7 इलेक्ट्रॉन मजबूत ऑक्सीकरण एजेंट हैं। धातुओं के साथ परस्पर क्रिया करते समय, एक आयनिक बंधन होता है और लवण बनते हैं। अधिक इलेक्ट्रोनगेटिव तत्वों के साथ बातचीत करते समय, हैलोजन (फ्लोरीन को छोड़कर) +7 की उच्चतम ऑक्सीकरण अवस्था तक कम करने वाले गुण भी प्रदर्शित कर सकते हैं।
जैसा कि ऊपर उल्लेख किया गया है, हैलोजन में उच्च प्रतिक्रियाशीलता होती है, इसलिए वे आमतौर पर प्रकृति में यौगिकों के रूप में पाए जाते हैं।
फ्लोरीन से आयोडीन तक बढ़ती परमाणु त्रिज्या के साथ पृथ्वी की पपड़ी में उनकी व्यापकता कम हो जाती है। पृथ्वी की पपड़ी में एस्टैटिन की मात्रा ग्राम में मापी जाती है, और यूनसेप्टियम प्रकृति में अनुपस्थित है। फ्लोरीन, क्लोरीन, ब्रोमीन और आयोडीन का उत्पादन औद्योगिक पैमाने पर किया जाता है, क्लोरीन की उत्पादन मात्रा अन्य तीन स्थिर हैलोजन की तुलना में काफी अधिक होती है।
प्रकृति में, ये तत्व मुख्य रूप से हैलाइड के रूप में पाए जाते हैं (आयोडीन के अपवाद के साथ, जो क्षार धातु नाइट्रेट जमा में सोडियम या पोटेशियम आयोडेट के रूप में भी होता है)। चूँकि कई क्लोराइड, ब्रोमाइड और आयोडाइड पानी में घुलनशील होते हैं, ये आयन समुद्र और प्राकृतिक नमकीन पानी में मौजूद होते हैं। फ्लोरीन का मुख्य स्रोत कैल्शियम फ्लोराइड है, जो बहुत थोड़ा घुलनशील है और तलछटी चट्टानों में पाया जाता है (फ्लोराइट सीएएफ 2 के रूप में)।
सरल पदार्थ प्राप्त करने का मुख्य तरीका हैलाइडों का ऑक्सीकरण है। उच्च धनात्मक मानक इलेक्ट्रोड विभव E o (F 2 /F ?) = +2.87 V तथा E o (Cl 2 /Cl ?) = +1.36 V दर्शाते हैं कि F आयन ऑक्सीकृत होते हैं? और सीएल? केवल मजबूत ऑक्सीकरण एजेंटों के साथ ही संभव है। उद्योग में, केवल इलेक्ट्रोलाइटिक ऑक्सीकरण का उपयोग किया जाता है। फ्लोरीन का उत्पादन करते समय, जलीय घोल का उपयोग नहीं किया जा सकता है, क्योंकि पानी बहुत कम क्षमता (+1.32 वी) पर ऑक्सीकरण करता है और परिणामी फ्लोरीन पानी के साथ तुरंत प्रतिक्रिया करेगा। फ्लोरीन पहली बार 1886 में फ्रांसीसी रसायनज्ञ हेनरी मोइसन द्वारा निर्जल हाइड्रोफ्लोरिक एसिड में पोटेशियम हाइड्रोफ्लोराइड केएचएफ 2 के समाधान के इलेक्ट्रोलिसिस द्वारा प्राप्त किया गया था।
उद्योग में, क्लोरीन का उत्पादन मुख्य रूप से विशेष इलेक्ट्रोलाइज़र में सोडियम क्लोराइड के जलीय घोल के इलेक्ट्रोलिसिस द्वारा किया जाता है। इस स्थिति में, निम्नलिखित प्रतिक्रियाएँ होती हैं:
एनोड पर अर्ध-प्रतिक्रिया:
कैथोड पर अर्ध-प्रतिक्रिया:
एनोड पर पानी के ऑक्सीकरण को एक इलेक्ट्रोड सामग्री का उपयोग करके दबाया जाता है जिसमें सीएल 2 की तुलना में ओ 2 के संबंध में अधिक ओवरवोल्टेज होता है (ऐसी सामग्री, विशेष रूप से, आरयूओ 2 है)।
आधुनिक इलेक्ट्रोलाइज़र में, कैथोड और एनोड रिक्त स्थान को एक बहुलक आयन-एक्सचेंज झिल्ली द्वारा अलग किया जाता है। झिल्ली Na+ धनायनों को एनोड स्थान से कैथोड स्थान तक जाने की अनुमति देती है। धनायनों का संक्रमण इलेक्ट्रोलाइज़र के दोनों हिस्सों में विद्युत तटस्थता बनाए रखता है, क्योंकि इलेक्ट्रोलिसिस के दौरान नकारात्मक आयन एनोड से हटा दिए जाते हैं (2Cl का सीएल 2 में रूपांतरण) और कैथोड (OH का निर्माण) पर जमा हो जाते हैं। ओह चल रहा है? विपरीत दिशा में भी विद्युत तटस्थता बनाए रखी जा सकती है, लेकिन OH आयन? सीएल 2 के साथ प्रतिक्रिया करेगा और पूरे परिणाम को नकार देगा।
ब्रोमीन समुद्री जल में पाए जाने वाले ब्रोमाइड आयन के रासायनिक ऑक्सीकरण द्वारा प्राप्त किया जाता है। I से भरपूर प्राकृतिक नमकीन पानी से आयोडीन प्राप्त करने के लिए इसी तरह की प्रक्रिया का उपयोग किया जाता है? . दोनों मामलों में, क्लोरीन, जिसमें मजबूत ऑक्सीकरण गुण होते हैं, को ऑक्सीकरण एजेंट के रूप में उपयोग किया जाता है, और परिणामी Br 2 और I 2 को हवा की एक धारा द्वारा समाधान से हटा दिया जाता है।
तालिका 1, कुछ गुणहैलोजन.
1.2 फ्लोरीन
एक अधातु तत्त्व(अव्य. फ्लोरम), एफ, मेंडेलीव की आवधिक प्रणाली के समूह VII का रासायनिक तत्व, हैलोजन, परमाणु क्रमांक 9, परमाणु द्रव्यमान 18.998403 से संबंधित है; सामान्य परिस्थितियों में (0 डिग्री सेल्सियस; 0.1 एमएन/एम2, या 1 किग्रा/सेमी2) यह तीखी गंध वाली हल्के पीले रंग की गैस है।
प्राकृतिक फ्लोरीन में एक स्थिर आइसोटोप 19 एफ होता है। कई आइसोटोप कृत्रिम रूप से प्राप्त किए गए हैं, विशेष रूप से: आधे जीवन टी ½ के साथ 16 एफ< 1 сек, 17 F (T Ѕ = 70 сек) , 18 F (T Ѕ = 111 мин) , 20 F (T Ѕ = 11,4 сек) , 21 F (T Ѕ = 5 сек).
ऐतिहासिक सन्दर्भ.पहला फ्लोरीन यौगिक - फ्लोराइट (फ्लोरस्पार) सीएएफ 2 - 15 वीं शताब्दी के अंत में "फ्लोर" नाम से वर्णित किया गया था (लैटिन फ्लूओ - प्रवाह से, धातुकर्म उत्पादन के चिपचिपे स्लैग को तरल बनाने के लिए सीएएफ 2 की संपत्ति के कारण) -बहता हुआ)। 1771 में, के. शीले ने हाइड्रोफ्लोरोइक एसिड प्राप्त किया। 1886 में ए मोइसन द्वारा अम्लीय पोटेशियम फ्लोराइड केएचएफ 2 के मिश्रण वाले तरल निर्जल हाइड्रोजन फ्लोराइड के इलेक्ट्रोलिसिस द्वारा मुक्त फ्लोरीन को अलग किया गया था।
फ्लोरीन रसायन विज्ञान 1930 के दशक में विकसित होना शुरू हुआ, विशेष रूप से 1939-45 के द्वितीय विश्व युद्ध के दौरान और उसके बाद परमाणु उद्योग और रॉकेटरी की जरूरतों के संबंध में तेजी से। 1810 में ए. एम्पीयर द्वारा प्रस्तावित नाम "फ्लोरीन" (ग्रीक फ़थोरोस से - विनाश, मृत्यु), केवल रूसी में उपयोग किया जाता है; कई देशों में "फ़्लोर" नाम स्वीकार किया जाता है।
प्रकृति में फ्लोरीन का वितरण.पृथ्वी की पपड़ी (क्लार्क) में औसत फ्लोरीन सामग्री द्रव्यमान के अनुसार 6.25·10 -2% है; अम्लीय आग्नेय चट्टानों (ग्रेनाइट) में यह 8·10 -2%, मूल चट्टानों में - 3.7·10 -2%, अल्ट्राबेसिक चट्टानों में - 1·10 -2% है। फ्लोरीन ज्वालामुखीय गैसों और तापीय जल में मौजूद होता है। सबसे महत्वपूर्ण फ्लोरीन यौगिक फ्लोराइट, क्रायोलाइट और पुखराज हैं। कुल मिलाकर, 80 से अधिक फ्लोरीन युक्त खनिज ज्ञात हैं। फ्लोरीन यौगिक एपेटाइट्स, फॉस्फोराइट्स और अन्य में भी पाए जाते हैं। फ्लोरीन एक महत्वपूर्ण बायोजेनिक तत्व है। पृथ्वी के इतिहास में, जीवमंडल में प्रवेश करने वाले फ्लोरीन का स्रोत ज्वालामुखी विस्फोट (गैसों, आदि) के उत्पाद थे।
फ्लोरीन के भौतिक गुण.गैसीय फ्लोरीन का घनत्व 1.693 ग्राम/लीटर (0°C और 0.1 Mn/m2, या 1 kgf/cm2), तरल - 1.5127 g/cm3 (क्वथनांक पर) होता है; टी पीएल -219.61 डिग्री सेल्सियस; क्वथनांक -188.13°C. फ्लोरीन अणु में दो परमाणु (एफ 2) होते हैं; 1000 डिग्री सेल्सियस पर 50% अणु अलग हो जाते हैं, पृथक्करण ऊर्जा लगभग 155 kJ/mol (37 kcal/mol) होती है। फ्लोरीन तरल हाइड्रोजन फ्लोराइड में खराब घुलनशील है; -70 डिग्री सेल्सियस पर 100 ग्राम एचएफ में घुलनशीलता 2.5·10 -3 ग्राम और -20 डिग्री सेल्सियस पर 0.4·10 -3 ग्राम; तरल रूप में, तरल ऑक्सीजन और ओजोन में असीमित घुलनशील।
फ्लोरीन के रासायनिक गुण.फ्लोरीन परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास 2s 2 2p 5 है। यौगिकों में यह -1 की ऑक्सीकरण अवस्था प्रदर्शित करता है। परमाणु की सहसंयोजक त्रिज्या 0.72E है, आयनिक त्रिज्या 1.3ZЕ है। इलेक्ट्रॉन आत्मीयता 3.62 eV, आयनीकरण ऊर्जा (F > F+) 17.418 eV। इलेक्ट्रॉन आत्मीयता और आयनीकरण ऊर्जा के उच्च मूल्य फ्लोरीन परमाणु की मजबूत इलेक्ट्रोनगेटिविटी की व्याख्या करते हैं, जो अन्य सभी तत्वों में सबसे बड़ा है। फ्लोरीन की उच्च प्रतिक्रियाशीलता फ्लोरीनेशन की एक्सोथर्मिक प्रकृति को निर्धारित करती है, जो बदले में, फ्लोरीन अणु की असामान्य रूप से कम पृथक्करण ऊर्जा और अन्य परमाणुओं के साथ फ्लोरीन परमाणु की बंधन ऊर्जा के बड़े मूल्यों से निर्धारित होती है। प्रत्यक्ष फ्लोराइडेशन में एक श्रृंखला तंत्र होता है और इससे आसानी से दहन और विस्फोट हो सकता है। फ्लोरीन हीलियम, नियॉन और आर्गन को छोड़कर सभी तत्वों के साथ प्रतिक्रिया करता है। यह चमक निर्वहन में ऑक्सीजन के साथ संपर्क करता है, जिससे कम तापमान पर ऑक्सीजन फ्लोराइड्स ओ 2 एफ 2, ओ 3 एफ 2 और अन्य बनते हैं। अन्य हैलोजन के साथ फ्लोरीन की अभिक्रिया ऊष्माक्षेपी होती है, जिसके परिणामस्वरूप इंटरहैलोजन यौगिकों का निर्माण होता है। 200-250 डिग्री सेल्सियस तक गर्म करने पर क्लोरीन फ्लोरीन के साथ क्रिया करता है, जिससे क्लोरीन मोनोफ्लोराइड सीएलएफ और क्लोरीन ट्राइफ्लोराइड सीएलएफ 3 मिलता है। सीएलएफ 5 भी जाना जाता है, जो उच्च तापमान और 25 एमएन/एम2 (250 किग्रा/सेमी2) के दबाव पर सीएलएफ 3 के फ्लोराइडेशन द्वारा प्राप्त किया जाता है। ) ब्रोमीन और आयोडीन सामान्य तापमान पर फ्लोरीन वातावरण में प्रज्वलित होते हैं, और BrF 3, BrF 5, IF 3, IF 2 प्राप्त किया जा सकता है। फ्लोरीन क्रिप्टन, क्सीनन और रेडॉन के साथ सीधे प्रतिक्रिया करता है, जिससे संबंधित फ्लोराइड बनता है (उदाहरण के लिए, XeF 4) , XeF 6, KrF 2 क्सीनन ऑक्सीफ्लोराइड्स भी जाने जाते हैं।
सल्फर के साथ फ्लोरीन की परस्पर क्रिया के साथ गर्मी निकलती है और कई सल्फर फ्लोराइड्स का निर्माण होता है। सेलेनियम और टेल्यूरियम उच्च फ्लोराइड्स SeF 6 और TeF 6 बनाते हैं। फ्लोरीन और हाइड्रोजन दहन के साथ प्रतिक्रिया करते हैं; इससे हाइड्रोजन फ्लोराइड उत्पन्न होता है। यह एक कट्टरपंथी श्रृंखला शाखा प्रतिक्रिया है:
एचएफ* + एच 2 = एचएफ + एच 2 *; एच 2 * + एफ 2 = एचएफ + एच + एफ
(जहाँ HF* और H2* कंपनात्मक रूप से उत्तेजित अवस्था में अणु हैं); प्रतिक्रिया का उपयोग रासायनिक लेजर में किया जाता है। फ्लोरीन नाइट्रोजन के साथ केवल विद्युत निर्वहन में प्रतिक्रिया करता है। चारकोल, फ्लोरीन के साथ बातचीत करते समय, सामान्य तापमान पर प्रज्वलित होता है; तीव्र ताप के तहत ग्रेफाइट इसके साथ प्रतिक्रिया करता है, और ठोस ग्रेफाइट फ्लोराइड (सीएफ) एक्स या गैसीय पेरफ्लोरोकार्बन सीएफ 4, सी 2 एफ 6 और अन्य का निर्माण संभव है। फ्लोरीन ठंड में बोरान, सिलिकॉन, फॉस्फोरस और आर्सेनिक के साथ प्रतिक्रिया करता है, जिससे संबंधित फ्लोराइड बनता है।
फ्लोरीन अधिकांश धातुओं के साथ तीव्रता से संयोजित होता है; क्षार और क्षारीय पृथ्वी धातुएँ ठंड में फ्लोरीन के वातावरण में प्रज्वलित होती हैं, Bi, Sn, Ti, Mo, W - मामूली ताप के साथ। Hg, Pb, U, V कमरे के तापमान पर फ्लोरीन के साथ प्रतिक्रिया करते हैं, Pt - गहरे लाल ताप तापमान पर। जब धातुएं फ्लोरीन के साथ प्रतिक्रिया करती हैं, तो आमतौर पर उच्च फ्लोराइड बनते हैं, उदाहरण के लिए यूएफ 6, एमओएफ 6, एचजीएफ 2। कुछ धातुएँ (Fe, Cu, Al, Ni, Mg, Zn) फ्लोरीन के साथ प्रतिक्रिया करके फ्लोराइड की एक सुरक्षात्मक फिल्म बनाती हैं, जो आगे की प्रतिक्रिया को रोकती है।
जब फ्लोरीन ठंड में धातु ऑक्साइड के साथ परस्पर क्रिया करता है, तो धातु फ्लोराइड और ऑक्सीजन बनते हैं; धातु ऑक्सीफ्लोराइड्स (उदाहरण के लिए, MoO 2 F 2) का निर्माण भी संभव है। गैर-धातु ऑक्साइड या तो फ्लोरीन जोड़ते हैं, उदाहरण के लिए SO 2 + F 2 = SO 2 F 2, या उनमें ऑक्सीजन को फ्लोरीन द्वारा प्रतिस्थापित किया जाता है, उदाहरण के लिए SiO 2 + 2F 2 = SiF 4 + O 2। ग्लास फ्लोरीन के साथ बहुत धीमी गति से प्रतिक्रिया करता है; पानी की उपस्थिति में प्रतिक्रिया तेजी से होती है। पानी फ्लोरीन के साथ परस्पर क्रिया करता है: 2H 2 O + 2F 2 = 4HF + O 2; इस स्थिति में OF 2 और हाइड्रोजन पेरोक्साइड H 2 O 2 भी बनते हैं। नाइट्रोजन ऑक्साइड NO और NO 2 आसानी से फ्लोरीन मिलाकर क्रमशः नाइट्रोसिल फ्लोराइड FNO और नाइट्राइल फ्लोराइड FNO 2 बनाते हैं। कार्बन मोनोऑक्साइड गर्म होने पर कार्बोनिल फ्लोराइड बनाने के लिए फ्लोरीन जोड़ता है:
सीओ + एफ 2 = सीओएफ 2.
धातु हाइड्रॉक्साइड फ्लोरीन के साथ प्रतिक्रिया करके धातु फ्लोराइड और ऑक्सीजन बनाते हैं, जैसे
2Ba(OH) 2 + 2F 2 = 2BaF 2 + 2H 2 O + O 2.
NaOH और KOH के जलीय घोल 0°C पर फ्लोरीन के साथ प्रतिक्रिया करके OF 2 बनाते हैं।
धातु या अधातु हैलाइड ठंड में फ्लोरीन के साथ प्रतिक्रिया करते हैं, फ्लोरीन सभी हैलोजन की जगह ले लेता है।
सल्फाइड, नाइट्राइड और कार्बाइड आसानी से फ्लोराइडयुक्त हो जाते हैं। धातु हाइड्राइड ठंड में फ्लोरीन के साथ धातु फ्लोराइड और एचएफ बनाते हैं; अमोनिया (वाष्प में) - एन 2 और एचएफ। फ्लोरीन एसिड या धातुओं में हाइड्रोजन को उनके लवण में प्रतिस्थापित करता है, उदाहरण के लिए HNO 3 (या NaNO 3) + F 2 = FNO 3 + HF (या NaF); उदाहरण के लिए, अधिक गंभीर परिस्थितियों में, फ्लोरीन इन यौगिकों से ऑक्सीजन को विस्थापित करता है, जिससे सल्फ्यूरिल फ्लोराइड बनता है
Na 2 SO 4 + 2F 2 = 2NaF + SO 2 F 2 + O 2.
क्षार और क्षारीय पृथ्वी धातुओं के कार्बोनेट सामान्य तापमान पर फ्लोरीन के साथ प्रतिक्रिया करते हैं; इससे संगत फ्लोराइड, CO 2 और O 2 उत्पन्न होता है।
फ्लोरीन कार्बनिक पदार्थों के साथ तीव्रता से प्रतिक्रिया करता है।
फ्लोरीन प्राप्त करना.फ्लोरीन के उत्पादन का स्रोत हाइड्रोजन फ्लोराइड है, जो मुख्य रूप से या तो फ्लोराइट सीएएफ 2 पर सल्फ्यूरिक एसिड एच 2 एसओ 4 · की क्रिया द्वारा या एपेटाइट्स और फॉस्फोराइट्स को संसाधित करके प्राप्त किया जाता है। फ्लोरीन का उत्पादन अम्लीय पोटेशियम फ्लोराइड KF-(1.8-2.0)HF के पिघल के इलेक्ट्रोलिसिस द्वारा किया जाता है, जो तब बनता है जब KF-HF पिघल को 40-41% HF की सामग्री तक हाइड्रोजन फ्लोराइड से संतृप्त किया जाता है। इलेक्ट्रोलाइज़र की सामग्री आमतौर पर स्टील होती है; इलेक्ट्रोड - कार्बन एनोड और स्टील कैथोड। इलेक्ट्रोलिसिस 95-100 डिग्री सेल्सियस और 9-11 वी के वोल्टेज पर किया जाता है; फ्लोरीन का वर्तमान उत्पादन 90-95% तक पहुँच जाता है। परिणामी फ्लोरीन में 5% तक एचएफ होता है, जिसे जमने के बाद सोडियम फ्लोराइड के साथ अवशोषण द्वारा हटा दिया जाता है। फ्लोरीन को गैसीय अवस्था में (दबाव में) और तरल रूप में (तरल नाइट्रोजन के साथ ठंडा होने पर) निकल और उस पर आधारित मिश्र धातु (मोनेल धातु), तांबा, एल्यूमीनियम और उसके मिश्र धातु, पीतल, स्टेनलेस स्टील से बने उपकरणों में संग्रहित किया जाता है।
फ्लोरीन का अनुप्रयोग.गैसीय फ्लोरीन का उपयोग यूएफ 4 के यूएफ 6 में फ्लोरिनेशन के लिए किया जाता है, यूरेनियम के आइसोटोप पृथक्करण के लिए उपयोग किया जाता है, साथ ही क्लोरीन ट्राइफ्लोराइड सीएलएफ 3 (फ्लोरिनेटिंग एजेंट), सल्फर हेक्साफ्लोराइड एसएफ 6 (विद्युत उद्योग में गैसीय इन्सुलेटर) के उत्पादन के लिए उपयोग किया जाता है। धातु फ्लोराइड्स (उदाहरण के लिए, डब्ल्यू और वी)। तरल फ्लोरीन रॉकेट ईंधन के लिए एक ऑक्सीकारक है।
कई फ्लोरीन यौगिकों का व्यापक रूप से उपयोग किया जाता है - हाइड्रोजन फ्लोराइड, एल्यूमीनियम फ्लोराइड, सिलिकोफ्लोराइड्स, फ्लोरोसल्फोनिक एसिड (विलायक, उत्प्रेरक, समूह वाले कार्बनिक यौगिकों के उत्पादन के लिए अभिकर्मक - एसओ 2 एफ), बीएफ 3 (उत्प्रेरक), ऑर्गेनोफ्लोरीन यौगिक और अन्य।
सुरक्षा सावधानियां।फ्लोरीन विषाक्त है, हवा में इसकी अधिकतम अनुमेय सांद्रता लगभग 2·10 -4 मिलीग्राम/लीटर है, और 1 घंटे से अधिक समय तक संपर्क में रहने पर अधिकतम अनुमेय सांद्रता 1.5·10 -3 मिलीग्राम/लीटर है।
शरीर में फ्लोराइड.फ्लोरीन लगातार जानवरों और पौधों के ऊतकों में शामिल होता है; सूक्ष्म तत्व अकार्बनिक यौगिकों के रूप में यह मुख्य रूप से जानवरों और मनुष्यों की हड्डियों में पाया जाता है - 100-300 मिलीग्राम/किग्रा; खासतौर पर दांतों में फ्लोराइड बहुत ज्यादा होता है। ज़मीनी जानवरों की हड्डियों की तुलना में समुद्री जानवरों की हड्डियों में फ्लोरीन की मात्रा अधिक होती है। यह मुख्य रूप से पीने के पानी के साथ जानवरों और मनुष्यों के शरीर में प्रवेश करता है, जिसमें इष्टतम फ्लोरीन सामग्री 1-1.5 मिलीग्राम/लीटर है। फ्लोराइड की कमी के साथ, एक व्यक्ति में दंत क्षय विकसित होता है, और बढ़े हुए सेवन के साथ - फ्लोरोसिस। फ्लोरीन आयनों की उच्च सांद्रता कई एंजाइमी प्रतिक्रियाओं को रोकने की क्षमता के साथ-साथ जैविक रूप से महत्वपूर्ण तत्वों को बांधने की उनकी क्षमता के कारण खतरनाक है। (पी, सीए, एमजी और अन्य), शरीर में उनके संतुलन को बाधित करते हैं। कार्बनिक फ्लोराइड व्युत्पन्न केवल कुछ पौधों में पाए जाते हैं (उदाहरण के लिए, दक्षिण अफ़्रीकी डिचापेटलम साइमोसम में)। मुख्य हैं फ़्लोरोएसिटिक एसिड के व्युत्पन्न, जो अन्य पौधों और जानवरों दोनों के लिए विषाक्त हैं। फ्लोराइड चयापचय और कंकाल की हड्डी के ऊतकों और विशेष रूप से दांतों के निर्माण के बीच एक संबंध स्थापित किया गया है।
फ्लोरीन युक्त यौगिकों के संश्लेषण और फॉस्फेट उर्वरकों के उत्पादन के दौरान, रासायनिक उद्योग में श्रमिकों के बीच फ्लोरीन विषाक्तता संभव है। फ्लोराइड श्वसन तंत्र को परेशान करता है और त्वचा जलने का कारण बनता है। तीव्र विषाक्तता में, स्वरयंत्र और ब्रांकाई, आंखों, लार और नाक के श्लेष्म झिल्ली में जलन होती है; गंभीर मामलों में - फुफ्फुसीय एडिमा, केंद्रीय तंत्रिका तंत्र को नुकसान और अन्य; पुराने मामलों में - नेत्रश्लेष्मलाशोथ, ब्रोंकाइटिस, निमोनिया, न्यूमोस्क्लेरोसिस, फ्लोरोसिस। एक्जिमा जैसे त्वचा के घाव इसकी विशेषता हैं। प्राथमिक उपचार: आंखों को पानी से धोना, त्वचा जलने पर - 70% अल्कोहल से सिंचाई करना; अंतःश्वसन विषाक्तता के मामले में - ऑक्सीजन का अंतःश्वसन। रोकथाम: सुरक्षा नियमों का अनुपालन, विशेष कपड़े पहनना, नियमित चिकित्सा जांच, आहार में कैल्शियम और विटामिन को शामिल करना।
1.3 क्लोरीन
क्लोरीन(अव्य. क्लोरम), सीएल, मेंडेलीव की आवधिक प्रणाली के समूह VII का रासायनिक तत्व, परमाणु क्रमांक 17, परमाणु द्रव्यमान 35.453; हैलोजन परिवार से संबंधित है। सामान्य परिस्थितियों में (0°C, 0.1 Mn/m2, या 1 kgf/cm2) यह एक तीखी, परेशान करने वाली गंध वाली पीली-हरी गैस है। प्राकृतिक क्लोरीन में दो स्थिर आइसोटोप होते हैं: 35 सीएल (75.77%) और 37 सीएल (24.23%)। द्रव्यमान संख्या 31-47 वाले रेडियोधर्मी आइसोटोप कृत्रिम रूप से प्राप्त किए गए हैं, विशेष रूप से: क्रमशः 32, 33, 34, 36, 38, 39, 40, 0.31 के अर्ध-जीवन (टी एस) के साथ; 2.5; 1.56 सेकंड; 3.1·105 वर्ष; 37.3, 55.5 और 1.4 मिनट। 36Cl और 38Cl का उपयोग समस्थानिक अनुरेखक के रूप में किया जाता है।
ऐतिहासिक सन्दर्भ.क्लोरीन पहली बार 1774 में के. शीले द्वारा पाइरोलुसाइट एमएनओ 2 के साथ हाइड्रोक्लोरिक एसिड की प्रतिक्रिया करके प्राप्त किया गया था। हालाँकि, केवल 1810 में जी. डेवी ने स्थापित किया कि क्लोरीन एक तत्व है और इसे क्लोरीन नाम दिया (ग्रीक क्लोरोस से - पीला-हरा)। 1813 में, जे. एल. गे-लुसाक ने इस तत्व के लिए क्लोरीन नाम प्रस्तावित किया।
प्रकृति में क्लोरीन का वितरण।क्लोरीन प्रकृति में केवल यौगिकों के रूप में पाया जाता है। पृथ्वी की पपड़ी (क्लार्क) में क्लोरीन की औसत सामग्री द्रव्यमान के हिसाब से 1.7·10 -2% है, अम्लीय आग्नेय चट्टानों - ग्रेनाइट और अन्य में - 2.4·10 -2, बुनियादी और अल्ट्राबेसिक चट्टानों में 5·10 -3 है। पृथ्वी की पपड़ी में क्लोरीन के इतिहास में मुख्य भूमिका जल प्रवास द्वारा निभाई जाती है। सीएल आयन के रूप में, यह विश्व महासागर (1.93%), भूमिगत नमकीन पानी और नमक झीलों में पाया जाता है। इसके स्वयं के खनिजों (मुख्य रूप से प्राकृतिक क्लोराइड) की संख्या 97 है, जिनमें से मुख्य हैलाइट NaCl (सेंधा नमक) है। पोटेशियम और मैग्नीशियम क्लोराइड और मिश्रित क्लोराइड के बड़े भंडार भी ज्ञात हैं: सिल्विनाइट KCl, सिल्विनाइट (Na,K)Cl, कार्नेलाइट KCl MgCl 2 6H 2 O, केनाइट KCl MgSO 4 3H 2 O, बिशोफाइट MgCl 2 6H 2 O इतिहास में पृथ्वी की पपड़ी के ऊपरी हिस्सों में ज्वालामुखीय गैसों में निहित एचसीएल की आपूर्ति का बहुत महत्व था।
क्लोरीन के भौतिक गुण.क्लोरीन का क्वथनांक -34.05°C, गलनांक -101°C होता है। सामान्य परिस्थितियों में क्लोरीन गैस का घनत्व 3.214 ग्राम/लीटर है; 0°C पर संतृप्त भाप 12.21 ग्राम/लीटर; 1.557 ग्राम/सेमी3 के क्वथनांक पर तरल क्लोरीन; ठोस क्लोरीन - 102°C 1.9 ग्राम/सेमी 3 पर। 0°C 0.369 पर क्लोरीन का संतृप्त वाष्प दबाव; 25°C पर 0.772; 100°C पर 3.814 Mn/m 2 या, क्रमशः, 3.69; 7.72; 38.14 किग्रा/सेमी2। संलयन की ऊष्मा 90.3 kJ/kg (21.5 cal/g); वाष्पीकरण की गर्मी 288 kJ/kg (68.8 cal/g); स्थिर दबाव पर गैस की ताप क्षमता 0.48 kJ/(kg K) है। क्लोरीन के महत्वपूर्ण स्थिरांक: तापमान 144°C, दबाव 7.72 Mn/m2 (77.2 kgf/cm2), घनत्व 573 g/l, विशिष्ट आयतन 1.745·10 -3 l/g। पानी में 0.1 एमएन/एम2, या 1 किग्राएफ/सेमी2 के आंशिक दबाव पर क्लोरीन की घुलनशीलता (जी/लीटर में), पानी में 14.8 (0°सेल्सियस), 5.8 (30°सेल्सियस), 2.8 (70°सेल्सियस); 300 ग्राम/लीटर NaCl 1.42 (30°C), 0.64 (70°C) के घोल में। 9.6°C से नीचे, परिवर्तनीय संरचना वाले क्लोरीन हाइड्रेट्स सीएल 2·एनएच 2 ओ (जहां एन = 6-8) जलीय घोल में बनते हैं; ये पीले घन क्रिस्टल हैं जो बढ़ते तापमान के साथ क्लोरीन और पानी में विघटित हो जाते हैं। क्लोरीन TiCl 4, SiCl 4, SnCl 4 और कुछ कार्बनिक सॉल्वैंट्स (विशेष रूप से हेक्सेन C 6 H 14 और कार्बन टेट्राक्लोराइड CCl 4) में अत्यधिक घुलनशील है। क्लोरीन अणु द्विपरमाणुक (Cl 2) है। 1000 K पर Cl 2 + 243 kJ = 2Cl के थर्मल पृथक्करण की डिग्री 2.07·10 -4%, 2500 K पर 0.909% है।
क्लोरीन के रासायनिक गुण.सीएल 3एस 2 एसपी 5 परमाणु का बाहरी इलेक्ट्रॉनिक विन्यास। इसके अनुसार, यौगिकों में क्लोरीन -1, +1, +3, +4, +5, +6 और +7 की ऑक्सीकरण अवस्था प्रदर्शित करता है। परमाणु की सहसंयोजक त्रिज्या 0.99 ई है, सीएल की आयनिक त्रिज्या 1.82 ई है, क्लोरीन परमाणु की इलेक्ट्रॉन बंधुता 3.65 ईवी है, और आयनीकरण ऊर्जा 12.97 ईवी है।
रासायनिक रूप से, क्लोरीन बहुत सक्रिय है, सीधे लगभग सभी धातुओं (कुछ के साथ केवल नमी की उपस्थिति में या गर्म होने पर) और गैर-धातुओं (कार्बन, नाइट्रोजन, ऑक्सीजन, अक्रिय गैसों को छोड़कर) के साथ मिलकर संबंधित क्लोराइड बनाता है, के साथ प्रतिक्रिया करता है। कई यौगिक, संतृप्त हाइड्रोकार्बन में हाइड्रोजन का स्थान ले लेते हैं और असंतृप्त यौगिकों में शामिल हो जाते हैं। क्लोरीन हाइड्रोजन और धातुओं के साथ अपने यौगिकों से ब्रोमीन और आयोडीन को विस्थापित करता है; इन तत्वों के साथ क्लोरीन के यौगिकों में से, इसे फ्लोरीन द्वारा प्रतिस्थापित किया जाता है। नमी के अंश की उपस्थिति में क्षार धातुएँ प्रज्वलित होकर क्लोरीन के साथ प्रतिक्रिया करती हैं; अधिकांश धातुएँ गर्म होने पर ही शुष्क क्लोरीन के साथ प्रतिक्रिया करती हैं। स्टील, साथ ही कुछ धातुएँ, कम तापमान पर शुष्क क्लोरीन के वातावरण में प्रतिरोधी होती हैं, इसलिए उनका उपयोग शुष्क क्लोरीन के लिए उपकरण और भंडारण सुविधाओं के निर्माण के लिए किया जाता है। फॉस्फोरस क्लोरीन के वातावरण में प्रज्वलित होता है, जिससे पीसीएल 3 बनता है, और आगे क्लोरीनीकरण के साथ - पीसीएल 5; गर्म करने पर क्लोरीन के साथ सल्फर एस 2 सीएल 2, एससीएल 2 और अन्य एस एन सीएल एम देता है। आर्सेनिक, एंटीमनी, बिस्मथ, स्ट्रोंटियम, टेल्यूरियम क्लोरीन के साथ तीव्रता से क्रिया करते हैं। क्लोरीन और हाइड्रोजन का मिश्रण हाइड्रोजन क्लोराइड के निर्माण के साथ रंगहीन या पीले-हरे रंग की लौ के साथ जलता है (यह एक श्रृंखला प्रतिक्रिया है)।
हाइड्रोजन-क्लोरीन ज्वाला का अधिकतम तापमान 2200°C होता है। 5.8 से 88.5% एच2 युक्त हाइड्रोजन के साथ क्लोरीन का मिश्रण विस्फोटक होता है।
ऑक्सीजन के साथ, क्लोरीन ऑक्साइड बनाता है: सीएल 2 ओ, सीएलओ 2, सीएल 2 ओ 6, सीएल 2 ओ 7, सीएल 2 ओ 8, साथ ही हाइपोक्लोराइट (हाइपोक्लोरस एसिड के लवण), क्लोराइट, क्लोरेट्स और परक्लोरेट्स। क्लोरीन के सभी ऑक्सीजन यौगिक आसानी से ऑक्सीकृत पदार्थों के साथ विस्फोटक मिश्रण बनाते हैं। क्लोरीन ऑक्साइड कमजोर रूप से स्थिर होते हैं और स्वचालित रूप से विस्फोट कर सकते हैं; हाइपोक्लोराइट भंडारण के दौरान धीरे-धीरे विघटित होते हैं; क्लोरेट्स और पर्क्लोरेट्स आरंभकर्ताओं के प्रभाव में विस्फोट कर सकते हैं।
पानी में क्लोरीन हाइड्रोलाइज हो जाता है, जिससे हाइपोक्लोरस और हाइड्रोक्लोरिक एसिड बनता है: सीएल 2 + एच 2 ओ = एचसीएलओ + एचसीएल। जब क्षार के जलीय घोल को ठंड में क्लोरीनीकृत किया जाता है, तो हाइपोक्लोराइट और क्लोराइड बनते हैं: 2NaOH + Cl 2 = NaClO + NaCl + H 2 O, और गर्म करने पर क्लोरेट बनते हैं। सूखे कैल्शियम हाइड्रॉक्साइड के क्लोरीनीकरण से ब्लीच बनता है।
जब अमोनिया क्लोरीन के साथ प्रतिक्रिया करता है, तो नाइट्रोजन ट्राइक्लोराइड बनता है। कार्बनिक यौगिकों को क्लोरीन करते समय, क्लोरीन या तो हाइड्रोजन का स्थान ले लेता है या कई बंधों से जुड़ जाता है, जिससे विभिन्न क्लोरीन युक्त कार्बनिक यौगिक बनते हैं।
क्लोरीन अन्य हैलोजन के साथ इंटरहैलोजन यौगिक बनाता है। फ्लोराइड्स सीएलएफ, सीएलएफ 3, सीएलएफ 3 बहुत प्रतिक्रियाशील हैं; उदाहरण के लिए, सीएलएफ 3 वातावरण में, कांच का ऊन अनायास ही प्रज्वलित हो जाता है। ऑक्सीजन और फ्लोरीन के साथ क्लोरीन के ज्ञात यौगिक क्लोरीन ऑक्सीफ्लोराइड्स हैं: सीएलओ 3 एफ, सीएलओ 2 एफ 3, सीएलओएफ, सीएलओएफ 3 और फ्लोरीन परक्लोरेट एफसीएलओ 4।
क्लोरीन प्राप्त करना. 1785 में मैंगनीज (II) ऑक्साइड या पायरोलुसाइट के साथ हाइड्रोक्लोरिक एसिड की प्रतिक्रिया करके औद्योगिक रूप से क्लोरीन का उत्पादन शुरू हुआ। 1867 में, अंग्रेजी रसायनज्ञ जी. डेकोन ने एक उत्प्रेरक की उपस्थिति में वायुमंडलीय ऑक्सीजन के साथ एचसीएल को ऑक्सीकरण करके क्लोरीन उत्पादन की एक विधि विकसित की। 19वीं सदी के अंत और 20वीं सदी की शुरुआत से, क्षार धातु क्लोराइड के जलीय घोल के इलेक्ट्रोलिसिस द्वारा क्लोरीन का उत्पादन किया गया है। ये विधियाँ दुनिया में 90-95% क्लोरीन का उत्पादन करती हैं। पिघले हुए क्लोराइड के इलेक्ट्रोलिसिस द्वारा मैग्नीशियम, कैल्शियम, सोडियम और लिथियम के उत्पादन में थोड़ी मात्रा में क्लोरीन उप-उत्पाद के रूप में प्राप्त किया जाता है। NaCl के जलीय घोल के इलेक्ट्रोलिसिस की दो मुख्य विधियों का उपयोग किया जाता है: 1) एक ठोस कैथोड और एक छिद्रपूर्ण फिल्टर डायाफ्राम के साथ इलेक्ट्रोलाइज़र में; 2) पारा कैथोड वाले इलेक्ट्रोलाइज़र में। दोनों तरीकों में, क्लोरीन गैस को ग्रेफाइट या ऑक्साइड टाइटेनियम-रूथेनियम एनोड पर छोड़ा जाता है। पहली विधि के अनुसार, कैथोड पर हाइड्रोजन छोड़ा जाता है और NaOH और NaCl का एक घोल बनाया जाता है, जिसमें से वाणिज्यिक कास्टिक सोडा को बाद के प्रसंस्करण द्वारा अलग किया जाता है। दूसरी विधि के अनुसार, कैथोड पर सोडियम अमलगम बनता है; जब इसे एक अलग उपकरण में शुद्ध पानी के साथ विघटित किया जाता है, तो एक NaOH समाधान, हाइड्रोजन और शुद्ध पारा प्राप्त होता है, जो फिर से उत्पादन में चला जाता है। दोनों विधियाँ प्रति 1 टन क्लोरीन में 1.125 टन NaOH देती हैं।
डायाफ्राम के साथ इलेक्ट्रोलिसिस में क्लोरीन के उत्पादन को व्यवस्थित करने के लिए कम पूंजी निवेश की आवश्यकता होती है और सस्ता NaOH उत्पन्न होता है। पारा कैथोड विधि बहुत शुद्ध NaOH उत्पन्न करती है, लेकिन पारा की हानि पर्यावरण को प्रदूषित करती है।
क्लोरीन का प्रयोग.रासायनिक उद्योग की महत्वपूर्ण शाखाओं में से एक क्लोरीन उद्योग है। क्लोरीन की मुख्य मात्रा को इसके उत्पादन स्थल पर क्लोरीन युक्त यौगिकों में संसाधित किया जाता है। क्लोरीन को सिलेंडर, बैरल, रेलवे टैंक या विशेष रूप से सुसज्जित जहाजों में तरल रूप में संग्रहीत और परिवहन किया जाता है। औद्योगिक देशों को क्लोरीन की निम्नलिखित अनुमानित खपत की विशेषता है: क्लोरीन युक्त कार्बनिक यौगिकों के उत्पादन के लिए - 60-75%; क्लोरीन युक्त अकार्बनिक यौगिक, -10-20%; लुगदी और कपड़ों को ब्लीच करने के लिए - 5-15%; स्वच्छता आवश्यकताओं और जल क्लोरीनीकरण के लिए - कुल उत्पादन का 2-6%।
क्लोरीन का उपयोग टाइटेनियम, नाइओबियम, ज़िरकोनियम और अन्य निकालने के लिए कुछ अयस्कों को क्लोरीनीकृत करने के लिए भी किया जाता है।
शरीर में क्लोरीन.क्लोरीन बायोजेनिक तत्वों में से एक है, जो पौधों और जानवरों के ऊतकों का एक निरंतर घटक है। पौधों में क्लोरीन की मात्रा (हेलोफाइट्स में बहुत अधिक क्लोरीन) एक प्रतिशत के हजारवें हिस्से से लेकर पूरे प्रतिशत तक, जानवरों में - एक प्रतिशत के दसवें और सौवें हिस्से तक होती है। एक वयस्क की क्लोरीन (2-4 ग्राम) की दैनिक आवश्यकता खाद्य उत्पादों से पूरी होती है। आमतौर पर भोजन के साथ सोडियम क्लोराइड और पोटेशियम क्लोराइड के रूप में क्लोरीन की अधिक मात्रा में आपूर्ति की जाती है। ब्रेड, मांस और डेयरी उत्पाद विशेष रूप से क्लोरीन से भरपूर होते हैं। पशु शरीर में, क्लोरीन रक्त प्लाज्मा, लसीका, मस्तिष्कमेरु द्रव और कुछ ऊतकों में मुख्य आसमाटिक रूप से सक्रिय पदार्थ है। पानी-नमक चयापचय में भूमिका निभाता है, पानी के ऊतक प्रतिधारण को बढ़ावा देता है। ऊतकों में एसिड-बेस संतुलन का विनियमन रक्त और अन्य ऊतकों के बीच क्लोरीन के वितरण को बदलकर अन्य प्रक्रियाओं के साथ किया जाता है। क्लोरीन पौधों में ऊर्जा चयापचय में शामिल है, ऑक्सीडेटिव फॉस्फोराइलेशन और फोटोफॉस्फोराइलेशन दोनों को सक्रिय करता है। जड़ों द्वारा ऑक्सीजन के अवशोषण पर क्लोरीन का सकारात्मक प्रभाव पड़ता है। पृथक क्लोरोप्लास्ट द्वारा प्रकाश संश्लेषण के दौरान ऑक्सीजन के उत्पादन के लिए क्लोरीन आवश्यक है। कृत्रिम पौधों की खेती के लिए अधिकांश पोषक माध्यम में क्लोरीन नहीं होता है। यह संभव है कि पौधों के विकास के लिए क्लोरीन की बहुत कम सांद्रता पर्याप्त हो।
रसायन, लुगदी और कागज, कपड़ा, दवा उद्योग और अन्य में क्लोरीन विषाक्तता संभव है। क्लोरीन आंखों और श्वसन पथ की श्लेष्मा झिल्ली को परेशान करता है। प्राथमिक सूजन संबंधी परिवर्तन आमतौर पर द्वितीयक संक्रमण के साथ होते हैं। तीव्र विषाक्तता लगभग तुरंत विकसित होती है। क्लोरीन की मध्यम और निम्न सांद्रता में साँस लेने पर, छाती में जकड़न और दर्द, सूखी खाँसी, तेजी से साँस लेना, आँखों में दर्द, लैक्रिमेशन, रक्त में ल्यूकोसाइट्स का बढ़ा हुआ स्तर, शरीर का तापमान आदि देखा जाता है। ब्रोन्कोपमोनिया, विषाक्त फुफ्फुसीय एडिमा , अवसाद, आक्षेप संभव है। हल्के मामलों में, 3-7 दिनों के भीतर रिकवरी हो जाती है। दीर्घकालिक परिणामों के रूप में, ऊपरी श्वसन पथ की सर्दी, आवर्तक ब्रोंकाइटिस, न्यूमोस्क्लेरोसिस और अन्य देखे जाते हैं; फुफ्फुसीय तपेदिक का संभावित सक्रियण। क्लोरीन की कम सांद्रता के लंबे समय तक साँस लेने के साथ, रोग के समान लेकिन धीरे-धीरे विकसित होने वाले रूप देखे जाते हैं। विषाक्तता की रोकथाम: उत्पादन सुविधाओं, उपकरणों को सील करना, प्रभावी वेंटिलेशन, यदि आवश्यक हो तो गैस मास्क का उपयोग करना। क्लोरीन, ब्लीच और अन्य क्लोरीन युक्त यौगिकों के उत्पादन को खतरनाक कामकाजी परिस्थितियों वाले उत्पादन के रूप में वर्गीकृत किया गया है।
1.4 ब्रोमीन
ब्रोमिन(अव्य. ब्रोमम), ब्र, मेंडेलीव की आवधिक प्रणाली के समूह VII का एक रासायनिक तत्व, हैलोजन से संबंधित है; परमाणु क्रमांक 35, परमाणु द्रव्यमान 79.904; तेज़ अप्रिय गंध वाला लाल-भूरा तरल। ब्रोमीन की खोज 1826 में फ्रांसीसी रसायनज्ञ ए.जे. बालार्ड द्वारा भूमध्यसागरीय नमक क्षेत्रों के नमकीन पानी का अध्ययन करते समय की गई थी; ग्रीक से नामित. ब्रोमोस - बदबू. प्राकृतिक ब्रोमीन में 2 स्थिर आइसोटोप 79 Br (50.54%) और 81 Br (49.46%) होते हैं। कृत्रिम रूप से प्राप्त रेडियोधर्मी आइसोटोप में से, ब्रोमीन सबसे दिलचस्प 80 Br है, जिसके उदाहरण पर I. V. Kurchatov ने परमाणु नाभिक के आइसोमेरिज्म की घटना की खोज की।
प्रकृति में ब्रोमीन का वितरण.पृथ्वी की पपड़ी में ब्रोमीन की मात्रा (द्रव्यमान के अनुसार 1.6·10 -4%) 10 15 -10 16 टन होने का अनुमान है। ब्रोमीन ज्यादातर आग्नेय चट्टानों के साथ-साथ व्यापक हैलाइडों में बिखरी हुई अवस्था में पाया जाता है। ब्रोमीन क्लोरीन का निरंतर साथी है। ब्रोमाइड लवण (NaBr, KBr, MgBr 2) क्लोराइड लवण (टेबल नमक में 0.03% Br तक, पोटेशियम लवण - सिल्वाइट और कार्नेलाइट - 0.3% Br तक) के साथ-साथ समुद्री जल (0.065) में पाए जाते हैं। % Br), नमक झील का नमकीन पानी (0.2% Br तक) और भूमिगत नमकीन पानी जो आमतौर पर नमक और तेल जमा (0.1% Br तक) से जुड़ा होता है। पानी में उनकी अच्छी घुलनशीलता के कारण, ब्रोमाइड लवण समुद्र और झील के जल निकायों के अवशिष्ट नमकीन पानी में जमा हो जाते हैं। ब्रोमीन आसानी से घुलनशील यौगिकों के रूप में स्थानांतरित होता है, बहुत ही कम ठोस खनिज रूपों का निर्माण करता है जो ब्रोमाइराइट एजीबीआर, एम्बोलाइट एजी (सीएल, बीआर) और आयोडेम्बोलाइट एजी (सीएल, बीआर, आई) द्वारा दर्शाए जाते हैं। खनिजों का निर्माण शुष्क रेगिस्तानी क्षेत्रों में बनने वाले सल्फाइड सिल्वर निक्षेपों के ऑक्सीकरण क्षेत्रों में होता है।
ब्रोमीन के भौतिक गुण.-7.2°C पर, तरल ब्रोमीन जम जाता है, और फीकी धात्विक चमक के साथ लाल-भूरे सुई के आकार के क्रिस्टल में बदल जाता है। ब्रोमीन वाष्प का रंग पीला-भूरा होता है, क्वथनांक 58.78°C होता है। तरल ब्रोमीन का घनत्व (20 डिग्री सेल्सियस पर) 3.1 ग्राम/सेमी 3 है। ब्रोमीन एक सीमित सीमा तक पानी में घुलनशील है, लेकिन अन्य हैलोजन से बेहतर है (20 डिग्री सेल्सियस पर 100 ग्राम एच2ओ में 3.58 ग्राम ब्रोमीन)। 5.84°C से नीचे, Br 2 8H 2 O के गार्नेट-लाल क्रिस्टल पानी से अवक्षेपित होते हैं। ब्रोमीन विशेष रूप से कई कार्बनिक सॉल्वैंट्स में घुलनशील है, जिसका उपयोग इसे जलीय घोल से निकालने के लिए किया जाता है। ठोस, तरल और गैसीय अवस्था में ब्रोमीन में 2-परमाणु अणु होते हैं। परमाणुओं में ध्यान देने योग्य पृथक्करण लगभग 800°C के तापमान पर शुरू होता है; प्रकाश के प्रभाव में भी पृथक्करण देखा जाता है।
ब्रोमीन के रासायनिक गुण.ब्रोमीन परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास 4s 2 4p 5 है। यौगिकों में ब्रोमीन की संयोजकता परिवर्तनशील है, ऑक्सीकरण अवस्था -1 है (ब्रोमाइड्स में, उदाहरण के लिए KBr), +1 (हाइपोब्रोमाइट्स में, NaBrO), +3 (ब्रोमाइट्स में, NaBrO 2), +5 (ब्रोमेट्स में, KBrOz) ) और +7 (पेरोब्रोमेट्स में, NaBrO4)। रासायनिक रूप से, ब्रोमीन बहुत सक्रिय है, क्लोरीन और आयोडीन के बीच प्रतिक्रियाशीलता में एक स्थान रखता है। सल्फर, सेलेनियम, टेल्यूरियम, फॉस्फोरस, आर्सेनिक और एंटीमनी के साथ ब्रोमीन की परस्पर क्रिया के साथ तेज ताप होता है, कभी-कभी लौ का भी आभास होता है। ब्रोमीन पोटेशियम और एल्युमीनियम जैसी कुछ धातुओं के साथ भी तीव्रता से प्रतिक्रिया करता है। हालाँकि, कई धातुएँ निर्जल ब्रोमीन के साथ प्रतिक्रिया करने में कठिनाई करती हैं क्योंकि उनकी सतह पर ब्रोमीन में अघुलनशील ब्रोमाइड की एक सुरक्षात्मक फिल्म बन जाती है। धातुओं में से, ऊंचे तापमान पर और नमी की उपस्थिति में भी, ब्रोमीन की क्रिया के प्रति सबसे अधिक प्रतिरोधी चांदी, सीसा, प्लैटिनम और टैंटलम हैं (सोना, प्लैटिनम के विपरीत, ब्रोमीन के साथ तीव्रता से प्रतिक्रिया करता है)। ऊंचे तापमान पर भी ब्रोमीन सीधे ऑक्सीजन, नाइट्रोजन और कार्बन के साथ संयोजित नहीं होता है। इन तत्वों के साथ ब्रोमीन यौगिक अप्रत्यक्ष रूप से प्राप्त होते हैं। ये अत्यंत नाजुक ऑक्साइड Br 2 O, Br O 2 और Br 3 O 8 हैं (बाद वाला, उदाहरण के लिए, 80°C पर ब्रोमीन पर ओजोन की क्रिया द्वारा प्राप्त किया जाता है)। ब्रोमीन हैलोजन के साथ सीधे प्रतिक्रिया करता है, जिससे BrF 3, BrF 5, BrCl, IBr और अन्य बनते हैं।
ब्रोमीन एक प्रबल ऑक्सीकरण एजेंट है। इस प्रकार, यह सल्फाइट्स और थायोसल्फेट्स को जलीय घोल में सल्फेट्स, नाइट्राइट को नाइट्रेट्स, अमोनिया को मुक्त नाइट्रोजन (3Br 2 + 8NH 3 = N 2 + NH 4 Br) में ऑक्सीकरण करता है। ब्रोमीन अपने यौगिकों से आयोडीन को विस्थापित करता है, लेकिन क्लोरीन और फ्लोरीन द्वारा स्वयं विस्थापित हो जाता है। अम्लीय वातावरण में मजबूत ऑक्सीकरण एजेंटों (KMnO 4, K 2 Cr 2 O 7) के प्रभाव में भी ब्रोमाइड के जलीय घोल से मुक्त ब्रोमीन निकलता है। पानी में घुलने पर, ब्रोमीन इसके साथ आंशिक रूप से प्रतिक्रिया करता है (Br 2 + H 2 O = HBr + HBrO) जिससे हाइड्रोब्रोमिक एसिड HBr और अस्थिर हाइपोब्रोमस एसिड HBrO बनता है। पानी में ब्रोमीन के घोल को ब्रोमीन जल कहा जाता है। जब ब्रोमीन ठंड में क्षार के घोल में घुल जाता है, तो ब्रोमाइड और हाइपोब्रोमाइट बनते हैं (2NaOH + Br 2 = NaBr + NaBrO + H 2 O), और ऊंचे तापमान (लगभग 100 डिग्री सेल्सियस) पर - ब्रोमाइड और ब्रोमेट (6NaOH + 3Br 2 =) 5NaBr + NaBrO 3 + 3H 2 O). कार्बनिक यौगिकों के साथ ब्रोमीन की प्रतिक्रियाओं में, सबसे विशिष्ट हैं C=C दोहरे बंधन पर जोड़, साथ ही हाइड्रोजन का प्रतिस्थापन (आमतौर पर उत्प्रेरक या प्रकाश की कार्रवाई के तहत)।
ब्रोमीन प्राप्त करना.ब्रोमीन के उत्पादन के लिए शुरुआती सामग्रियां समुद्री जल, झील और भूमिगत नमकीन पानी और पोटेशियम उत्पादन वाली शराब हैं जिनमें ब्रोमाइड आयन बीआर के रूप में ब्रोमीन होता है - (समुद्री पानी में 65 ग्राम/मीटर 3 से 3-4 किलोग्राम/मीटर 3 और अधिक तक) पोटेशियम शराब उत्पादन में)। ब्रोमीन को क्लोरीन (2Br - + Cl 2 = Br 2 + 2Cl -) की सहायता से पृथक किया जाता है और जल वाष्प या वायु के साथ घोल से आसुत किया जाता है। स्टीम स्ट्रिपिंग ग्रेनाइट, सिरेमिक या ब्रोमीन के प्रति प्रतिरोधी अन्य सामग्री से बने स्तंभों में की जाती है। गर्म नमकीन पानी को ऊपर से स्तंभ में डाला जाता है, और क्लोरीन और जल वाष्प को नीचे से आपूर्ति की जाती है। स्तंभ से निकलने वाला ब्रोमीन वाष्प सिरेमिक रेफ्रिजरेटर में संघनित होता है। इसके बाद, ब्रोमीन को पानी से अलग किया जाता है और आसवन द्वारा क्लोरीन की अशुद्धियों से शुद्ध किया जाता है। एयर स्ट्रिपिंग से ब्रोमीन प्राप्त करने के लिए ब्रोमीन की कम सामग्री वाले ब्राइन का उपयोग करना संभव हो जाता है; उच्च भाप खपत के परिणामस्वरूप भाप द्वारा ब्रोमीन निकालना लाभहीन है। रासायनिक अवशोषक का उपयोग करके ब्रोमीन को परिणामी ब्रोमीन-वायु मिश्रण से हटा दिया जाता है। इसके लिए, आयरन ब्रोमाइड (2FeBr 2 + Br 2 = 2FeBr 3) के घोल का उपयोग किया जाता है, जो बदले में, लोहे के बुरादे के साथ FeBr 3 को कम करके प्राप्त किया जाता है, साथ ही सोडियम हाइड्रॉक्साइड या कार्बोनेट या गैसीय सल्फर डाइऑक्साइड के घोल के साथ प्रतिक्रिया करता है। हाइड्रोब्रोमिक और सल्फ्यूरिक एसिड (Br 2 + SO 2 + 2H 2 O = 2HBr + H 2 SO 4) के निर्माण के साथ जल वाष्प की उपस्थिति में ब्रोमीन। ब्रोमीन को क्लोरीन (FeBr 3 और HBr से) या एसिड (5NaBr + NaBrO 3 + 3 H 2 SO 4 = 3Br 2 + 3Na 2 SO 4 + 3H 2 O) की क्रिया द्वारा परिणामी मध्यवर्ती से अलग किया जाता है। यदि आवश्यक हो, तो मध्यवर्ती उत्पादों को मौलिक ब्रोमीन जारी किए बिना ब्रोमाइड यौगिकों में संसाधित किया जाता है।
ब्रोमीन वाष्प का साँस लेना जब हवा में इसकी सामग्री 1 मिलीग्राम/एम3 या अधिक होती है तो खांसी, नाक बहना, नाक से खून आना, चक्कर आना, सिरदर्द होता है; उच्च सांद्रता पर - दम घुटना, ब्रोंकाइटिस, और कभी-कभी मृत्यु। हवा में ब्रोमीन वाष्प की अधिकतम अनुमेय सांद्रता 2 mg/m3 है। तरल ब्रोमीन त्वचा पर कार्य करता है, जिससे जलन ठीक से ठीक नहीं होती है। ब्रोमीन के साथ काम धूआं हुडों में किया जाना चाहिए। ब्रोमीन वाष्प के साथ विषाक्तता के मामले में, इस उद्देश्य के लिए पानी या एथिल अल्कोहल में इसके अत्यधिक पतला घोल का उपयोग करके अमोनिया को अंदर लेने की सिफारिश की जाती है। ब्रोमीन वाष्प सूंघने से होने वाली गले की खराश गर्म दूध पीने से दूर हो जाती है। त्वचा पर लगने वाला ब्रोमीन बहुत सारे पानी से धोया जाता है या हवा की तेज धारा के साथ उड़ा दिया जाता है। जले हुए क्षेत्रों को लैनोलिन से चिकनाई दी जाती है।
ब्रोमीन का अनुप्रयोग.ब्रोमीन का प्रयोग काफी व्यापक रूप से किया जाता है। यह कई ब्रोमाइड लवण और कार्बनिक डेरिवेटिव के उत्पादन के लिए शुरुआती उत्पाद है। ब्रोमीन की बड़ी मात्रा का उपयोग एथिल ब्रोमाइड और डाइब्रोमोइथेन का उत्पादन करने के लिए किया जाता है - एथिल तरल के घटकों को उनके विस्फोट प्रतिरोध को बढ़ाने के लिए गैसोलीन में जोड़ा जाता है। ब्रोमीन यौगिकों का उपयोग फोटोग्राफी में किया जाता है, कई रंगों के उत्पादन में, मिथाइल ब्रोमाइड और कुछ अन्य ब्रोमीन यौगिकों का उपयोग कीटनाशकों के रूप में किया जाता है। कुछ कार्बनिक ब्रोमीन यौगिक प्रभावी आग बुझाने वाले एजेंट के रूप में काम करते हैं। कई पदार्थों को निर्धारित करने के लिए रासायनिक विश्लेषण में ब्रोमीन और ब्रोमीन पानी का उपयोग किया जाता है। दवा में, सोडियम, पोटेशियम, अमोनियम ब्रोमाइड्स का उपयोग किया जाता है, साथ ही कार्बनिक ब्रोमीन यौगिकों का उपयोग किया जाता है, जिनका उपयोग न्यूरोसिस, हिस्टीरिया, बढ़ती चिड़चिड़ापन, अनिद्रा, उच्च रक्तचाप, मिर्गी और कोरिया के लिए किया जाता है।
शरीर में ब्रोमीन.ब्रोमीन जानवरों और पौधों के ऊतकों का एक निरंतर घटक है। स्थलीय पौधों में कच्चे पदार्थ में औसतन 7·10 -4% ब्रोमीन होता है, जानवरों में ~1·10 -4%। ब्रोमीन विभिन्न स्रावों (आँसू, लार, पसीना, दूध, पित्त) में पाया जाता है। एक स्वस्थ व्यक्ति के रक्त में ब्रोमीन की मात्रा 0.11 से 2.00 मिलीग्राम% तक होती है। रेडियोधर्मी ब्रोमीन (82 बीआर) का उपयोग करके, थायरॉयड ग्रंथि, गुर्दे की मज्जा और पिट्यूटरी ग्रंथि द्वारा इसका चयनात्मक अवशोषण स्थापित किया गया था। जानवरों और मनुष्यों के शरीर में पेश किए गए ब्रोमाइड सेरेब्रल कॉर्टेक्स में निरोधात्मक प्रक्रियाओं की एकाग्रता को बढ़ाते हैं और तंत्रिका तंत्र की स्थिति को सामान्य करने में मदद करते हैं, जो निरोधात्मक प्रक्रिया के अत्यधिक तनाव से पीड़ित है। उसी समय, थायरॉयड ग्रंथि में रहकर, ब्रोमीन आयोडीन के साथ प्रतिस्पर्धी संबंध में प्रवेश करता है, जो ग्रंथि की गतिविधि को प्रभावित करता है, और इसके संबंध में, चयापचय की स्थिति को प्रभावित करता है।
1.5 आयोडीन
आयोडीन(अव्य। आयोडम), I, मेंडेलीव की आवधिक प्रणाली के समूह VII का एक रासायनिक तत्व, हैलोजन से संबंधित है (पुराना नाम आयोडीन और प्रतीक J भी साहित्य में पाए जाते हैं); परमाणु क्रमांक 53, परमाणु द्रव्यमान 126.9045; धात्विक चमक के साथ काले-भूरे रंग के क्रिस्टल। प्राकृतिक आयोडीन में 127 की द्रव्यमान संख्या के साथ एक स्थिर आइसोटोप होता है। आयोडीन की खोज 1811 में फ्रांसीसी रसायनज्ञ बी. कोर्टोइस ने की थी। समुद्री शैवाल की राख की मातृ नमकीन को सांद्र सल्फ्यूरिक एसिड के साथ गर्म करके, उन्होंने बैंगनी वाष्प (इसलिए नाम आयोडीन - ग्रीक आयोड से, आयोइड्स - रंग में बैंगनी जैसा, बैंगनी) की रिहाई देखी, जो गहरे चमकदार प्लेट की तरह संघनित हो गई क्रिस्टल. 1813-1814 में, फ्रांसीसी रसायनज्ञ जे.एल. गे-लुसाक और अंग्रेजी रसायनज्ञ जी. डेवी ने आयोडीन की मौलिक प्रकृति को साबित किया।
प्रकृति में आयोडीन का वितरण.पृथ्वी की पपड़ी में औसत आयोडीन सामग्री द्रव्यमान के अनुसार 4·10 -5% है। आयोडीन यौगिक मेंटल और मैग्मा और उनसे बनी चट्टानों (ग्रेनाइट, बेसाल्ट और अन्य) में बिखरे हुए हैं; आयोडीन के गहरे खनिज अज्ञात हैं। पृथ्वी की पपड़ी में आयोडीन का इतिहास जीवित पदार्थ और बायोजेनिक प्रवासन से निकटता से जुड़ा हुआ है। जीवमंडल में, इसकी सांद्रता की प्रक्रियाएँ देखी जाती हैं, विशेष रूप से समुद्री जीवों (शैवाल, स्पंज और अन्य) द्वारा। आठ सुपरजीन आयोडीन खनिज जीवमंडल में बनने के लिए जाने जाते हैं, लेकिन वे बहुत दुर्लभ हैं। जीवमंडल के लिए आयोडीन का मुख्य भंडार विश्व महासागर है (1 लीटर में औसतन 5·10 -5 ग्राम आयोडीन होता है)। समुद्र से, समुद्री जल की बूंदों में घुले आयोडीन यौगिक वायुमंडल में प्रवेश करते हैं और हवाओं द्वारा महाद्वीपों तक ले जाए जाते हैं। (समुद्र से दूर या पहाड़ों द्वारा समुद्री हवाओं से घिरे क्षेत्रों में आयोडीन की कमी हो जाती है।) आयोडीन मिट्टी और समुद्री गाद में कार्बनिक पदार्थों द्वारा आसानी से अवशोषित हो जाता है। जब ये गाद सघन हो जाती है और तलछटी चट्टानें बन जाती हैं, तो अवशोषण होता है और कुछ आयोडीन यौगिक भूजल में चले जाते हैं। इस प्रकार आयोडीन के निष्कर्षण के लिए उपयोग किया जाने वाला आयोडीन-ब्रोमीन पानी बनता है, विशेष रूप से तेल क्षेत्र क्षेत्रों की विशेषता (कुछ स्थानों पर, इन पानी के 1 लीटर में 100 मिलीग्राम से अधिक आयोडीन होता है)।
आयोडीन के भौतिक गुण.आयोडीन घनत्व 4.94 ग्राम/सेमी 3, गलनांक 113.5°C, क्वथनांक 184.35°C है। तरल और गैसीय आयोडीन के अणु में दो परमाणु (I 2) होते हैं। I 2 = 2I का ध्यान देने योग्य पृथक्करण 700 डिग्री सेल्सियस से ऊपर, साथ ही प्रकाश के प्रभाव में भी देखा जाता है। पहले से ही सामान्य तापमान पर, आयोडीन वाष्पित हो जाता है, जिससे तेज गंध वाला बैंगनी वाष्प बनता है। थोड़ा गर्म करने पर, आयोडीन उदात्त हो जाता है, चमकदार पतली प्लेटों के रूप में जम जाता है; यह प्रक्रिया प्रयोगशालाओं और उद्योग में आयोडीन को शुद्ध करने का काम करती है। आयोडीन पानी में खराब घुलनशील है (25 डिग्री सेल्सियस पर 0.33 ग्राम/लीटर), कार्बन डाइसल्फ़ाइड और कार्बनिक सॉल्वैंट्स (बेंजीन, अल्कोहल और अन्य) में अच्छी तरह से घुलनशील है, साथ ही आयोडाइड के जलीय घोल में भी घुलनशील है।
आयोडीन के रासायनिक गुण.आयोडीन परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास 5s 2 5p 5 है। इसके अनुसार, आयोडीन यौगिकों में परिवर्तनशील संयोजकता (ऑक्सीकरण अवस्था) प्रदर्शित करता है: -1 (HI, KI में), +1 (HIO, KIO में), +3 (ICl 3 में), +5 (HIO 3, KIO में) 3 ) और +7 (एचआईओ 4, केआईओ 4 में)। रासायनिक रूप से, आयोडीन काफी सक्रिय है, हालांकि क्लोरीन और ब्रोमीन की तुलना में कुछ हद तक। थोड़ा गर्म करने पर आयोडीन धातुओं के साथ तीव्रता से प्रतिक्रिया करता है, जिससे आयोडाइड (Hg + I 2 = HgI 2) बनता है। आयोडीन गर्म होने पर ही हाइड्रोजन के साथ प्रतिक्रिया करता है, पूरी तरह से नहीं, जिससे हाइड्रोजन आयोडाइड बनता है। आयोडीन सीधे कार्बन, नाइट्रोजन या ऑक्सीजन के साथ संयोजित नहीं होता है। एलिमेंटल आयोडीन एक ऑक्सीकरण एजेंट है, जो क्लोरीन और ब्रोमीन से कम शक्तिशाली है। हाइड्रोजन सल्फाइड H 2 S, सोडियम थायोसल्फेट Na 2 S 2 O 3 और अन्य कम करने वाले एजेंट इसे I - (I 2 + H 2 S = S + 2HI) तक कम कर देते हैं। जलीय घोल में क्लोरीन और अन्य मजबूत ऑक्सीकरण एजेंट इसे IO 3 - (5Cl 2 + I 2 + 6H 2 O = 2HIO 3 H + 10HCl) में बदल देते हैं। पानी में घुलने पर, आयोडीन आंशिक रूप से इसके साथ प्रतिक्रिया करता है (I 2 + H 2 O = HI + HIO); क्षार के गर्म जलीय घोल में आयोडाइड और आयोडेट बनते हैं (3I 2 + 6NaOH = 5NaI + NaIO 3 + 3H 2 O)। स्टार्च पर अधिशोषित होने पर, आयोडीन इसे गहरा नीला कर देता है; इसका उपयोग आयोडोमेट्री और आयोडीन का पता लगाने के लिए गुणात्मक विश्लेषण में किया जाता है।
आयोडीन वाष्प जहरीले होते हैं और श्लेष्म झिल्ली को परेशान करते हैं। आयोडीन का त्वचा पर रोगनाशक और कीटाणुनाशक प्रभाव होता है। आयोडीन के दाग सोडा या सोडियम थायोसल्फेट के घोल से धोए जाते हैं।
आयोडीन प्राप्त करना.आयोडीन के औद्योगिक उत्पादन के लिए कच्चा माल तेल ड्रिलिंग पानी है; समुद्री शैवाल, साथ ही चिली (सोडियम) नाइट्रेट के मूल घोल में सोडियम आयोडेट के रूप में 0.4% तक आयोडीन होता है। तेल के पानी से आयोडीन निकालने के लिए (आमतौर पर आयोडाइड के रूप में 20-40 मिलीग्राम/लीटर आयोडीन होता है), उन्हें पहले क्लोरीन (2 NaI + Cl 2 = 2NaCl + I 2) या नाइट्रस एसिड (2NaI + 2NaNO 2 +) से उपचारित किया जाता है। 2H 2 SO 4 = 2Na 2 SO 4 + 2NO + I 2 + 2H 2 O)। जारी आयोडीन या तो सक्रिय कार्बन द्वारा सोख लिया जाता है या हवा के साथ उड़ा दिया जाता है। कोयले द्वारा अधिशोषित आयोडीन को कास्टिक क्षार या सोडियम सल्फाइट (I 2 + Na 2 SO 3 + H 2 O = Na 2 SO 4 + 2HI) के साथ उपचारित किया जाता है। मुक्त आयोडीन को क्लोरीन या सल्फ्यूरिक एसिड और एक ऑक्सीकरण एजेंट की क्रिया द्वारा प्रतिक्रिया उत्पादों से अलग किया जाता है, उदाहरण के लिए, पोटेशियम डाइक्रोमेट (K 2 Cr 2 O 7 + 7H 2 SO 4 + 6NaI = K 2 SO 4 + 3Na 2 SO 4 + सीआर 2 (एसओ 4)एस + 3आई 2)। हवा के साथ उड़ाए जाने पर, आयोडीन को जल वाष्प (2H 2 O + SO 2 + I 2 = H 2 SO 4 + 2HI) के साथ सल्फर ऑक्साइड (IV) के मिश्रण द्वारा अवशोषित किया जाता है और फिर आयोडीन को क्लोरीन (2HI + Cl) से बदल दिया जाता है। 2 = 2HCl + I 2). अपरिष्कृत क्रिस्टलीय आयोडीन को उर्ध्वपातन द्वारा शुद्ध किया जाता है।
आयोडीन का अनुप्रयोग.आयोडीन और इसके यौगिकों का उपयोग मुख्य रूप से चिकित्सा और विश्लेषणात्मक रसायन विज्ञान के साथ-साथ कार्बनिक संश्लेषण और फोटोग्राफी में भी किया जाता है।
शरीर में आयोडीन.आयोडीन जानवरों और मनुष्यों के लिए आवश्यक एक सूक्ष्म तत्व है। टैगा-वन गैर-चेरनोज़म, शुष्क मैदान, रेगिस्तान और पर्वतीय जैव-रासायनिक क्षेत्रों की मिट्टी और पौधों में, आयोडीन अपर्याप्त मात्रा में होता है या कुछ अन्य सूक्ष्म तत्वों (Co, Mn, Cu) के साथ संतुलित नहीं होता है; यह इन क्षेत्रों में स्थानिक गण्डमाला के प्रसार से जुड़ा है। मिट्टी में औसत आयोडीन सामग्री लगभग 3·10 -4%, पौधों में लगभग 2·10 -5% है। सतही पेयजल में आयोडीन बहुत कम है (10 -7 से 10 -9%)। तटीय क्षेत्रों में, हवा के 1 m3 में आयोडीन की मात्रा 50 mcg तक पहुँच सकती है, महाद्वीपीय और पहाड़ी क्षेत्रों में यह 1 या 0.2 mcg तक होती है।
पौधों द्वारा आयोडीन का अवशोषण मिट्टी में इसके यौगिकों की सामग्री और पौधे के प्रकार पर निर्भर करता है। कुछ जीव (तथाकथित आयोडीन सांद्रक), उदाहरण के लिए, समुद्री शैवाल - फुकस, केल्प, फाइलोफोरा, 1% तक आयोडीन जमा करते हैं, कुछ स्पंज - 8.5% तक (कंकाल पदार्थ स्पोंगिन में)। आयोडीन को सांद्रित करने वाले शैवाल का उपयोग इसके औद्योगिक उत्पादन के लिए किया जाता है। आयोडीन भोजन, पानी और हवा के साथ पशु शरीर में प्रवेश करता है। आयोडीन का मुख्य स्रोत पादप उत्पाद और चारा हैं। आयोडीन का अवशोषण छोटी आंत के अग्र भाग में होता है। मानव शरीर में 20 से 50 मिलीग्राम आयोडीन जमा होता है, जिसमें मांसपेशियों में लगभग 10-25 मिलीग्राम और थायरॉयड ग्रंथि में 6-15 मिलीग्राम शामिल होता है। रेडियोधर्मी आयोडीन (131 I और 125 I) का उपयोग करते हुए, यह दिखाया गया कि थायरॉयड ग्रंथि में आयोडीन उपकला कोशिकाओं के माइटोकॉन्ड्रिया में जमा होता है और उनमें बनने वाले डायोडो- और मोनोआयोडोटायरोसिन का हिस्सा होता है, जो हार्मोन टेट्राआयोडोथायरोनिन (थायरोक्सिन) में संघनित होता है। आयोडीन शरीर से मुख्य रूप से गुर्दे (70-80% तक), स्तन, लार और पसीने की ग्रंथियों, आंशिक रूप से पित्त के साथ उत्सर्जित होता है।
विभिन्न जैव-भू-रासायनिक प्रांतों में, दैनिक आहार में आयोडीन की मात्रा भिन्न-भिन्न होती है (मनुष्यों के लिए 20 से 240 एमसीजी, भेड़ के लिए 20 से 400 एमसीजी तक)। किसी जानवर की आयोडीन की आवश्यकता उसकी शारीरिक स्थिति, वर्ष का समय, तापमान और पर्यावरण में आयोडीन सामग्री के लिए शरीर के अनुकूलन पर निर्भर करती है। मनुष्यों और जानवरों में आयोडीन की दैनिक आवश्यकता शरीर के वजन के प्रति 1 किलोग्राम में लगभग 3 एमसीजी है (गर्भावस्था के दौरान वृद्धि, विकास में वृद्धि और ठंडक के दौरान वृद्धि)। शरीर में आयोडीन की शुरूआत बेसल चयापचय को बढ़ाती है, ऑक्सीडेटिव प्रक्रियाओं को बढ़ाती है, मांसपेशियों को टोन करती है और यौन क्रिया को उत्तेजित करती है।
भोजन और पानी में आयोडीन की अधिक या कम कमी के कारण, टेबल नमक के आयोडीनीकरण का उपयोग किया जाता है, जिसमें आमतौर पर प्रति 1 टन नमक में 10-25 ग्राम पोटेशियम आयोडाइड होता है। आयोडीन युक्त उर्वरकों के उपयोग से फसलों में इसकी मात्रा दोगुनी या तिगुनी हो सकती है।
औषधि में आयोडीन.आयोडीन युक्त तैयारी में जीवाणुरोधी और एंटिफंगल गुण होते हैं, उनके पास एक विरोधी भड़काऊ और ध्यान भटकाने वाला प्रभाव भी होता है; इनका उपयोग बाह्य रूप से घावों को कीटाणुरहित करने और शल्य चिकित्सा क्षेत्र को तैयार करने के लिए किया जाता है। जब मौखिक रूप से लिया जाता है, तो आयोडीन की तैयारी चयापचय को प्रभावित करती है और थायराइड समारोह को बढ़ाती है। आयोडीन (माइक्रोआयोडीन) की छोटी खुराक थायरॉयड ग्रंथि के कार्य को रोकती है, जिससे पूर्वकाल पिट्यूटरी ग्रंथि में थायरॉयड-उत्तेजक हार्मोन का निर्माण प्रभावित होता है। चूंकि आयोडीन प्रोटीन और वसा (लिपिड) चयापचय को प्रभावित करता है, इसलिए इसे एथेरोस्क्लेरोसिस के उपचार में आवेदन मिला है, क्योंकि यह रक्त में कोलेस्ट्रॉल को कम करता है; रक्त की फाइब्रिनोलिटिक गतिविधि को भी बढ़ाता है। नैदानिक उद्देश्यों के लिए, आयोडीन युक्त रेडियोपैक एजेंटों का उपयोग किया जाता है।
आयोडीन की तैयारी के लंबे समय तक उपयोग और उनके प्रति संवेदनशीलता में वृद्धि के साथ, आयोडिज्म प्रकट हो सकता है - बहती नाक, पित्ती, क्विन्के की सूजन, लार और लैक्रिमेशन, मुँहासे जैसे दाने (आयोडोडर्मा), आदि। फुफ्फुसीय तपेदिक के मामले में आयोडीन की तैयारी नहीं ली जानी चाहिए , गर्भावस्था, गुर्दे की बीमारी, क्रोनिक पायोडर्मा, रक्तस्रावी प्रवणता, पित्ती।
आयोडीन रेडियोधर्मी है.आयोडीन के कृत्रिम रूप से रेडियोधर्मी आइसोटोप - 125 I, 131 I, 132 I और अन्य का व्यापक रूप से थायरॉयड ग्रंथि की कार्यात्मक स्थिति निर्धारित करने और इसके कई रोगों के इलाज के लिए जीव विज्ञान और विशेष रूप से चिकित्सा में उपयोग किया जाता है। निदान में रेडियोधर्मी आयोडीन का उपयोग थायरॉयड ग्रंथि में चुनिंदा रूप से जमा होने की आयोडीन की क्षमता से जुड़ा है; औषधीय प्रयोजनों के लिए उपयोग ग्रंथि की स्रावी कोशिकाओं को नष्ट करने के लिए आयोडीन रेडियोआइसोटोप के बीटा-विकिरण की क्षमता पर आधारित है। जब पर्यावरण परमाणु विखंडन उत्पादों से दूषित होता है, तो आयोडीन के रेडियोधर्मी आइसोटोप तेजी से जैविक चक्र में प्रवेश करते हैं, अंततः दूध में और परिणामस्वरूप, मानव शरीर में समाप्त हो जाते हैं। बच्चों के शरीर में उनका प्रवेश विशेष रूप से खतरनाक है, जिनकी थायरॉयड ग्रंथि वयस्कों की तुलना में 10 गुना छोटी है और रेडियो संवेदनशीलता भी अधिक है। थायरॉयड ग्रंथि में आयोडीन के रेडियोधर्मी आइसोटोप के जमाव को कम करने के लिए, स्थिर आयोडीन तैयारी (प्रति खुराक 100-200 मिलीग्राम) का उपयोग करने की सिफारिश की जाती है। रेडियोधर्मी आयोडीन जठरांत्र संबंधी मार्ग से जल्दी और पूरी तरह से अवशोषित हो जाता है और चुनिंदा रूप से थायरॉयड ग्रंथि में जमा हो जाता है। इसका अवशोषण ग्रंथि की कार्यात्मक अवस्था पर निर्भर करता है। आयोडीन के रेडियोआइसोटोप की अपेक्षाकृत उच्च सांद्रता लार और स्तन ग्रंथियों और जठरांत्र संबंधी मार्ग की श्लेष्मा झिल्ली में भी पाई जाती है। थायरॉयड ग्रंथि द्वारा अवशोषित नहीं होने वाला रेडियोधर्मी आयोडीन लगभग पूरी तरह से और अपेक्षाकृत तेज़ी से मूत्र में उत्सर्जित होता है।
समान दस्तावेज़
हैलोजन की अवधारणा और मूल गुणों का अध्ययन - रासायनिक तत्व (फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन), जो आवर्त सारणी डी.आई. के समूह VII के मुख्य उपसमूह का गठन करते हैं। मेंडेलीव। मानव शरीर पर हैलोजन के सकारात्मक और नकारात्मक प्रभाव।
प्रस्तुति, 10/20/2011 जोड़ा गया
खोज का इतिहास और रासायनिक तत्वों की आवर्त सारणी में स्थान डी.आई. मेंडेलीव हैलोजन: फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन। तत्वों के रासायनिक और भौतिक गुण, उनका अनुप्रयोग। तत्वों की व्यापकता एवं सरल पदार्थों का उत्पादन।
प्रस्तुति, 03/13/2014 को जोड़ा गया
हैलोजन से संबंधित रासायनिक तत्व: फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन। रासायनिक विशेषताएं, तत्वों की परमाणु संख्या, उनके भौतिक गुण, आयनीकरण ऊर्जा और इलेक्ट्रोनगेटिविटी। हैलोजन की ऑक्सीकरण अवस्थाएँ, पृथक्करण ऊर्जा।
प्रस्तुति, 12/16/2013 को जोड़ा गया
हैलोजन की अवधारणा और व्यावहारिक महत्व, उनके भौतिक और रासायनिक गुण, विशिष्ट विशेषताएं। हैलोजन उत्पादन की विशेषताएँ और विधियाँ: आयोडीन, ब्रोमीन, क्लोरीन, फ्लोरीन, एस्टैटिन। इन हैलोजन की विशेषताएँ, उनके उपयोग के क्षेत्र।
प्रस्तुति, 03/11/2011 को जोड़ा गया
आवर्त सारणी के समूह IV के रासायनिक तत्वों की सामान्य विशेषताएँ, प्रकृति में उनकी उपस्थिति और अन्य गैर-धातुओं के साथ यौगिक। जर्मेनियम, टिन और सीसा तैयार करना। टाइटेनियम उपसमूह की धातुओं के भौतिक-रासायनिक गुण। ज़िरकोनियम के अनुप्रयोग के क्षेत्र.
प्रस्तुति, 04/23/2014 को जोड़ा गया
हैलोजन मेंडेलीव की आवधिक प्रणाली के समूह VII के मुख्य उपसमूह से संबंधित रासायनिक तत्व हैं। हैलोजन में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन शामिल हैं। सभी हैलोजन ऊर्जावान ऑक्सीकरण एजेंट हैं और इसलिए प्रकृति में केवल यौगिकों के रूप में पाए जाते हैं।
सार, 03/20/2009 जोड़ा गया
क्लोरीन तीसरी अवधि के रासायनिक तत्वों की आवर्त सारणी का 17वां तत्व है, जिसका परमाणु क्रमांक 17 है। एक रासायनिक रूप से सक्रिय गैर-धातु, हैलोजन समूह का हिस्सा। क्लोरीन के भौतिक गुण, धातुओं और अधातुओं के साथ परस्पर क्रिया, ऑक्सीडेटिव प्रतिक्रियाएं।
प्रस्तुति, 12/26/2011 को जोड़ा गया
नाइट्रोजन उपसमूह के तत्वों के गुण, परमाणुओं की संरचना और विशेषताएं। आवर्त सारणी में तत्वों को ऊपर से नीचे ले जाने पर धात्विक गुणों में वृद्धि। प्रकृति में नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और बिस्मथ का वितरण, उनका अनुप्रयोग।
सार, 06/15/2009 जोड़ा गया
हैलोजन के भौतिक और रासायनिक गुण, मेंडेलीव की तत्वों की आवर्त सारणी में उनकी स्थिति। क्लोरीन, ब्रोमीन, आयोडीन, फ्लोरीन के मुख्य स्रोत एवं जैविक महत्व। प्रकृति में हैलोजन की खोज, उनका उत्पादन और औद्योगिक उपयोग।
प्रस्तुति, 12/01/2014 को जोड़ा गया
धातुओं की सामान्य विशेषताएँ. परिभाषा, संरचना. सामान्य भौतिक गुण. धातुएँ प्राप्त करने की विधियाँ। धातुओं के रासायनिक गुण. मिश्र धातु। मुख्य उपसमूहों के तत्वों की विशेषताएँ। संक्रमण धातुओं के लक्षण.
आवर्त सारणी के समूह VII में शामिल तत्वों को दो उपसमूहों में विभाजित किया गया है: मुख्य एक - हैलोजन उपसमूह - और द्वितीयक एक - मैंगनीज उपसमूह। हाइड्रोजन को भी इस समूह में रखा गया है, हालाँकि इसके परमाणु के बाहरी, संयोजकता स्तर पर एक ही इलेक्ट्रॉन होता है और इसे समूह I में रखा जाना चाहिए। हालाँकि, मुख्य उपसमूह के दोनों तत्वों - क्षार धातुओं और द्वितीयक उपसमूह के तत्वों - तांबा, चांदी और सोने के साथ हाइड्रोजन में बहुत कम समानता है। साथ ही, हैलोजन की तरह, यह सक्रिय धातुओं के साथ प्रतिक्रिया में एक इलेक्ट्रॉन जोड़ता है और हाइड्राइड बनाता है जिसमें हैलाइड के साथ कुछ समानताएं होती हैं।
हैलोजन के उपसमूह में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन शामिल हैं। पहले चार तत्व प्रकृति में पाए जाते हैं, अंतिम तत्व कृत्रिम रूप से प्राप्त किया जाता है और इसलिए इसका अध्ययन अन्य हैलोजन की तुलना में बहुत कम किया गया है। हैलोजन शब्द का अर्थ है नमक बनाना। उपसमूह के तत्वों को यह नाम उस आसानी के कारण मिला है जिसके साथ वे कई धातुओं के साथ प्रतिक्रिया करते हैं, जिससे लवण बनते हैं। सभी हैलोजन में बाहरी इलेक्ट्रॉन शेल एस 2 पी 5 की संरचना होती है। इसलिए, वे आसानी से एक इलेक्ट्रॉन को स्वीकार करते हैं, जिससे एक स्थिर नोबल गैस इलेक्ट्रॉन शेल (एस 2 पी 6) बनता है। उपसमूह में फ्लोरीन की परमाणु त्रिज्या सबसे छोटी है; बाकी के लिए यह श्रृंखला F में बढ़ती है< Cl < Br < I < Аt и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов к электрону. Галогены - очень активные элементы. Они могут отнимать, электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор - бром из бромидов, а бром - иод из иодидов. Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше одного неспаренного электрона и проявляет валентность только -1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода К подгруппе марганца принадлежат марганец, технеций и рений. В отличии от галогенов элементы подгруппы марганца имеют на внешнем электронном уровне всего два электрона и поэтому не проявляют способности присоединять электроны, образуя отрицательно заряженные ионы.Марганец распространен в природе и широко используется в промышленности.Технеций радиоактивен, в природе не встречаемся, а получен искусственно (впервые - Э. Сегре и К.Перрье, 1937}. Этот элемент образуется вследствие радиоактивного распада урана. Рений относится к числу рассеянных элементов. Он не образует самостоятельных минералов, а встречается в качестве спутника некоторых минералов, особенно молибденовых. Он был открыт В. и И. Ноддак в 1925 г. Сплавы, имеющие небольшие добавки рения, обладают повышенной устойчивостью против коррозии. Добавка рения к и ее сплавам увеличивает их механическую прочность. Это свойство рения позволяет применять его вместо благородного металла иридия. Платино-платинорениевые термопары работают лучше платино-платиноиридиевых, но их нельзя использовать при очень высоких температурах, так как образуется летучее соединение Re 2 O 7 .
अधातुओं की एक विशिष्ट विशेषता उनके परमाणुओं के बाहरी ऊर्जा स्तर में इलेक्ट्रॉनों की बड़ी संख्या (धातुओं की तुलना में) है। यह अतिरिक्त इलेक्ट्रॉनों को संलग्न करने और धातुओं की तुलना में उच्च ऑक्सीडेटिव गतिविधि प्रदर्शित करने की उनकी अधिक क्षमता को निर्धारित करता है। विशेष रूप से मजबूत ऑक्सीकरण गुण, यानी इलेक्ट्रॉनों को जोड़ने की क्षमता, समूह VI-VII की दूसरी और तीसरी अवधि में स्थित गैर-धातुओं द्वारा प्रदर्शित की जाती है। यदि हम फ्लोरीन, क्लोरीन और अन्य हैलोजन के परमाणुओं में ऑर्बिटल्स में इलेक्ट्रॉनों की व्यवस्था की तुलना करते हैं, तो हम उनके विशिष्ट गुणों का अनुमान लगा सकते हैं। फ्लोरीन परमाणु में कोई मुक्त कक्षा नहीं है। इसलिए, फ्लोरीन परमाणु केवल संयोजकता I और ऑक्सीकरण अवस्था 1 प्रदर्शित कर सकते हैं। सबसे मजबूत ऑक्सीकरण एजेंट फ्लोरीन है। अन्य हैलोजन के परमाणुओं में, उदाहरण के लिए क्लोरीन परमाणु में, समान ऊर्जा स्तर पर मुक्त डी-ऑर्बिटल्स होते हैं। इसके कारण, इलेक्ट्रॉन युग्मन तीन अलग-अलग तरीकों से हो सकता है। पहले मामले में, क्लोरीन +3 की ऑक्सीकरण अवस्था प्रदर्शित कर सकता है और क्लोरस एसिड HClO2 बना सकता है, जो लवण - क्लोराइट से मेल खाता है, उदाहरण के लिए पोटेशियम क्लोराइट KClO2। दूसरे मामले में, क्लोरीन ऐसे यौगिक बना सकता है जिसमें क्लोरीन की ऑक्सीकरण अवस्था +5 है। ऐसे यौगिकों में हाइपोक्लोरस एसिड HClO3 और इसके लवण - क्लोरेट्स, उदाहरण के लिए पोटेशियम क्लोरेट KClO3 (बर्थोलेट नमक) शामिल हैं। तीसरे मामले में, क्लोरीन +7 की ऑक्सीकरण अवस्था प्रदर्शित करता है, उदाहरण के लिए परक्लोरिक एसिड HClO4 और इसके लवण, परक्लोरेट्स (पोटेशियम परक्लोरेट KClO4 में)।
एमएन 2+ आयनों की विशेष विश्लेषणात्मक प्रतिक्रियाएं
1.5.5. सोडियम बिस्मथेट NaBiO3 के साथ ऑक्सीकरण समीकरण के अनुसार होता है:
2Mn(NO 3) 2 + 5NaBiO 3 + 16HNO 3 = 2HMnO 4 + 5Bi(NO 3) 3 + 5NaNO 3 + 7H 2 O.
ठंड में प्रतिक्रिया होती है. प्रतिक्रिया निष्पादित करना:मैंगनीज नमक के घोल की 1-2 बूंदों में 6 एम एचएनओ 3 घोल की 3-4 बूंदें और एच 2 ओ की 5-6 बूंदें मिलाएं, जिसके बाद एक स्पैटुला के साथ थोड़ा सा NaBiO 3 पाउडर मिलाएं। टेस्ट ट्यूब की सामग्री को मिलाने के बाद, इसे 1-2 मिनट तक खड़े रहने दें, फिर अतिरिक्त सोडियम बिस्मथेट को अलग करने के लिए सेंट्रीफ्यूज करें। एमएन 2+ की उपस्थिति में, मैंगनीज एसिड के गठन के परिणामस्वरूप समाधान बैंगनी हो जाता है, जो सबसे शक्तिशाली ऑक्सीकरण एजेंटों में से एक है।
1.5.6. गर्म करने पर नाइट्रिक एसिड माध्यम में लेड डाइऑक्साइड के साथ PbO2 का ऑक्सीकरण:
2Mn(NO 3) 2 + 5PbO 2 + 6HNO 3 → 2HMnO 4 + 5Pb(NO 3) 2 + 2H 2 O.
प्रतिक्रिया निष्पादित करना:थोड़ा सा PbO 2 पाउडर लें और इसे एक टेस्ट ट्यूब में रखें, वहां 6 M HNO 3 की 4-5 बूंदें डालें और हिलाते हुए गर्म करें। बैंगनी रंग का दिखना Mn 2+ की उपस्थिति को दर्शाता है।
1.5.7. विश्लेषण में महत्व क्षार धातु कार्बोनेट के साथ एमएन 2+ की प्रतिक्रियाएं, सोडियम हाइड्रोजन फॉस्फेट, अमोनियम परसल्फेट के साथ ऑक्सीकरण प्रतिक्रियाएं, एमएन 4+ यौगिकों के साथ बेंज़िडाइन का ऑक्सीकरण, एमएन 2+ आयनों के साथ एजीसीएल की धात्विक चांदी में कमी है।
88. समूह VIII B के तत्व। सबसे महत्वपूर्ण यौगिकों के विशिष्ट गुण. जैविक भूमिका. Fe 3+ और Fe 2+ आयनों के लिए विश्लेषणात्मक प्रतिक्रियाएं।
लौह उपसमूह- रासायनिक तत्वों की आवर्त सारणी के समूह 8 के रासायनिक तत्व (पुराने वर्गीकरण के अनुसार - समूह VIII के द्वितीयक उपसमूह के तत्व)। समूह में शामिल हैं लोहाफे, दयातारु और आज़मियमओस. परमाणु के इलेक्ट्रॉनिक विन्यास के आधार पर कृत्रिम रूप से संश्लेषित तत्व भी उसी समूह का होता है हंसी Hs, जिसकी खोज 1984 में हेवी आयन रिसर्च सेंटर (जर्मन) में की गई थी। गेसेलशाफ्ट फर श्वेरियननफोर्सचुंग, जीएसआई), डार्मस्टेड, जर्मनी UNILAC त्वरक से लौह-58 आयनों की किरण के साथ एक सीसा (208 पीबी) लक्ष्य पर बमबारी के परिणामस्वरूप। प्रयोग के परिणामस्वरूप, 3 265 एचएस नाभिक संश्लेषित किए गए, जिन्हें α-क्षय श्रृंखला के मापदंडों द्वारा विश्वसनीय रूप से पहचाना गया। एक साथ और स्वतंत्र रूप से, उसी प्रतिक्रिया का अध्ययन JINR (डुबना, रूस) में किया गया, जहां, 253 Es नाभिक के α-क्षय की 3 घटनाओं के अवलोकन के आधार पर, यह भी निष्कर्ष निकाला गया कि इस प्रतिक्रिया में 265 Hs नाभिक, विषय α-क्षय के लिए, संश्लेषित किया गया था। समूह 8 के सभी तत्वों के संयोजकता कोश में 8 इलेक्ट्रॉन होते हैं। समूह के दो तत्व - रूथेनियम और ऑस्मियम - प्लैटिनम धातु परिवार से संबंधित हैं। अन्य समूहों की तरह, समूह 8 के तत्वों के सदस्य इलेक्ट्रॉनिक विन्यास के पैटर्न प्रदर्शित करते हैं, विशेष रूप से उनके बाहरी आवरण में, हालांकि, अजीब तरह से, रूथेनियम इस प्रवृत्ति का पालन नहीं करता है। हालाँकि, इस समूह के तत्व भौतिक गुणों और रासायनिक व्यवहार में भी समानताएँ दिखाते हैं: लोहा अपने शुद्ध रूप में प्रकृति में बहुत कम पाया जाता है; यह अक्सर लौह-निकल उल्कापिंडों में पाया जाता है। पृथ्वी की पपड़ी में लोहे की व्यापकता 4.65% (ऑक्सीजन, सिलिकॉन और एल्यूमीनियम के बाद चौथा स्थान) है। यह भी माना जाता है कि लोहा पृथ्वी के अधिकांश भाग का निर्माण करता है।
रूथेनियम जीवित जीवों में पाई जाने वाली एकमात्र प्लैटिनम धातु है। (कुछ स्रोतों के अनुसार - प्लैटिनम भी)। मुख्य रूप से मांसपेशी ऊतक में केंद्रित। उच्च रूथेनियम ऑक्साइड अत्यंत विषैला होता है और, एक मजबूत ऑक्सीकरण एजेंट होने के कारण, ज्वलनशील पदार्थों के दहन का कारण बन सकता है।
विश्लेषणात्मक प्रतिक्रियाएँ
पोटेशियम हेक्सासायनोफेरेट (III) K 3, Fe 2+ धनायन के साथ "टर्नबूल ब्लू" का नीला अवक्षेप बनाता है:
3FeSO 4 + 2K 3 → Fe 3 2 ↓+ 3K 2 SO 4,
3Fe 2+ + 2Fe(CN) 6 3– → Fe 3 2 ↓।
अवक्षेप अम्लों में नहीं घुलता, बल्कि क्षार के साथ विघटित होकर Fe(OH) 2 बनाता है। यदि अभिकर्मक की अधिकता हो तो अवक्षेप हरा हो जाता है। प्रतिक्रिया में Fe 3+ आयनों द्वारा हस्तक्षेप किया जाता है, जो उच्च सांद्रता पर अभिकर्मक को समाधान को भूरा रंग देते हैं, और Mn 2+ और Bi 3+ आयन, जो अभिकर्मक को कमजोर रंग का अवक्षेप देते हैं, एसिड में घुलनशील होते हैं। प्रतिक्रियाएँ निष्पादित करना।एक परखनली में FeSO4 घोल की 1-2 बूंदें डालें और अभिकर्मक की 1 बूंद डालें। परिणामी अवक्षेप को दो भागों में विभाजित करें, पहले में 2 एम एचसी1 घोल की 1-2 बूंदें और दूसरे में 2 एम क्षार घोल की 1-2 बूंदें डालें। प्रतिक्रिया की स्थितियाँ अम्लीय वातावरण में तनु विलयन के साथ होती हैं, pH = 3।
1.5.2.> Fe 2+ से Fe 3+ का ऑक्सीकरण। Fe 2+ आयन एक काफी मजबूत कम करने वाला एजेंट है और इसे कई ऑक्सीकरण एजेंटों की कार्रवाई के तहत ऑक्सीकरण किया जा सकता है, उदाहरण के लिए, अम्लीय वातावरण में H 2 O 2, KMnO 4, K 2 Cr 2 O 7, आदि।
2Fe 2+ + 4OH - + H 2 O 2 → 2Fe(OH) 3 ↓।
एक व्यवस्थित विश्लेषण करते समय, प्रारंभिक परीक्षणों में Fe 2+ की खोज की जानी चाहिए, क्योंकि समूह पृथक्करण की प्रक्रिया में, Fe 2+ को Fe 3+ में ऑक्सीकृत किया जा सकता है।
Fe 3+ आयनों की विशेष विश्लेषणात्मक प्रतिक्रियाएँ
1.5.3. पोटेशियम हेक्सासायनोफेरेट (II) K 4, Fe 3+ धनायनों के साथ "प्रशिया नीला" का गहरा नीला अवक्षेप बनाता है:
4Fe 3+ + 3Fe(CN) 6 4– → Fe 4 3 ↓।
अवक्षेप व्यावहारिक रूप से एसिड में अघुलनशील होता है, लेकिन क्षार द्वारा विघटित होकर Fe(OH) 3 बनाता है। अभिकर्मक की अधिकता में, अवक्षेप स्पष्ट रूप से घुल जाता है। प्रतिक्रिया क्रियान्वित करना. FeCl3 घोल की 1-2 बूंदों में अभिकर्मक की 1 बूंद मिलाएं। परिणामी अवक्षेप को दो भागों में बाँट लें। एक भाग में 2 M HC1 घोल की 2-3 बूँदें, दूसरे में 2 M NaOH घोल की 1-2 बूँदें डालें, मिलाएँ।
1.5.4. Fe 3+ आयनों के साथ पोटेशियम थायोसाइनेट (रोडानाइड) KNCS एक रक्त-लाल कॉम्प्लेक्स बनाता है। थायोसाइनेट की सांद्रता के आधार पर, विभिन्न रचनाओं के कॉम्प्लेक्स बन सकते हैं:
Fe 3+ + NCS - ↔ Fe(NCS) 2+,
Fe 3+ + 2NCS - ↔ Fe(NCS) 2+,
वगैरह। से Fe 3+ + 6NCS – ↔ Fe(NCS) 6 3– ,
प्रतिक्रिया प्रतिवर्ती है, इसलिए अभिकर्मक अधिक मात्रा में लिया जाता है। निर्धारण में उन आयनों द्वारा हस्तक्षेप किया जाता है जो Fe 3+ के साथ स्थिर परिसरों का निर्माण करते हैं, उदाहरण के लिए, फ्लोराइड आयन, फॉस्फोरिक, ऑक्सालिक और साइट्रिक एसिड के लवण।
89. समूह I B के तत्व। सबसे महत्वपूर्ण यौगिकों के विशिष्ट गुण, जैविक भूमिका। Ag + और Cu 2+ आयनों का जीवाणुनाशक प्रभाव। चांदी और तांबे के आयनों के लिए विश्लेषणात्मक प्रतिक्रियाएं।
n = 4 Cu ns1(n-1)d10, बाहरी स्तर - 1 ē,
प्रीएक्सटर्नल - 18 ē
n = 5 Ag अयुग्मित ē - एक(विफलता, फिसलन), लेकिन
n = 6 एयू 18 - इलेक्ट्रॉनिक परत, उपसमूह में स्थिर
जस्ता, अभी तक यहाँ और पूरी तरह से स्थिर नहीं हुआ है
ē खोने में सक्षम, इसलिए CO संभव है
IB समूह के केवल d-तत्व ऐसे यौगिक बनाते हैं जिनमें CO, N समूह से अधिक है, और यह Cu2+, Ag+, Au+3 के लिए अधिक स्थिर है।
दोहरे आवेश वाले तांबे के आयनों की एक विशिष्ट संपत्ति अमोनिया अणुओं के साथ मिलकर जटिल आयन बनाने की उनकी क्षमता है। तांबा ट्रेस तत्वों में से एक है। Fe, Cu, Mn, Mo, B, Zn, Co को यह नाम इस तथ्य के कारण मिला है कि पौधों के सामान्य कामकाज के लिए इनकी थोड़ी मात्रा आवश्यक है। सूक्ष्म तत्व एंजाइमों की गतिविधि को बढ़ाते हैं, चीनी, स्टार्च, प्रोटीन, न्यूक्लिक एसिड, विटामिन और एंजाइमों के संश्लेषण को बढ़ावा देते हैं। चाँदी एक कम सक्रिय धातु है। वायु वातावरण में यह कमरे के तापमान पर या गर्म होने पर ऑक्सीकरण नहीं करता है। चांदी की वस्तुओं का अक्सर देखा जाने वाला कालापन उनकी सतह पर काले सिल्वर सल्फाइड - एजीएस 2 - के गठन का परिणाम है। यह हवा में निहित हाइड्रोजन सल्फाइड के प्रभाव में होता है, साथ ही जब चांदी की वस्तुएं सल्फर यौगिकों वाले खाद्य उत्पादों के संपर्क में आती हैं। 4Ag + 2H 2 S + O 2 -> 2Ag 2 S + 2H 2 OV वोल्टेज रेंज में , चांदी हाइड्रोजन ode से बहुत आगे स्थित है। इसलिए, हाइड्रोक्लोरिक और तनु सल्फ्यूरिक एसिड का इस पर कोई प्रभाव नहीं पड़ता है। चांदी आमतौर पर नाइट्रिक एसिड में घुल जाती है, जो समीकरण के अनुसार इसके साथ बातचीत करती है: Ag + 2HNO 3 -> AgNO 3 + NO 2 + H 2 O चांदी लवणों की एक श्रृंखला बनाती है, जिसके घोल में रंगहीन Ag + धनायन होते हैं। जब क्षार होता है सिल्वर लवण के घोल पर कार्य करें, AgOH प्राप्त करने की उम्मीद की जा सकती है, लेकिन इसके बजाय सिल्वर (I) ऑक्साइड का एक भूरा अवक्षेप अवक्षेपित होता है: 2AgNO 3 + 2NaOH -> Ag 2 O + 2NaNO 3 + H 2 O सिल्वर (I) के अलावा ) ऑक्साइड, ऑक्साइड AgO और Ag 2 O 3 ज्ञात हैं। सिल्वर नाइट्रेट (लैपिस) - AgNO 3 - रंगहीन पारदर्शी क्रिस्टल बनाता है, जो पानी में अत्यधिक घुलनशील होता है। इसका उपयोग फोटोग्राफिक सामग्रियों के उत्पादन में, दर्पणों के निर्माण में, इलेक्ट्रोप्लेटिंग में और चिकित्सा में किया जाता है। तांबे की तरह, चांदी में जटिल यौगिक बनाने की प्रवृत्ति होती है। कई पानी में अघुलनशील चांदी के यौगिक (उदाहरण के लिए: सिल्वर (आई) ऑक्साइड) - एजी 2 ओ और सिल्वर क्लोराइड - एजी सीएल), अमोनिया के जलीय घोल में आसानी से घुल जाते हैं। जटिल सिल्वर साइनाइड यौगिकों का उपयोग गैल्वेनिक सिल्वर के लिए किया जाता है, क्योंकि इन लवणों के घोल के इलेक्ट्रोलिसिस के दौरान महीन-क्रिस्टलीय सिल्वर की एक घनी परत जमा हो जाती है। उत्पादों की सतह। धात्विक सिल्वर पा के निकलने से सभी सिल्वर यौगिक आसानी से कम हो जाते हैं। यदि कांच के कंटेनर में सिल्वर (I) ऑक्साइड के अमोनिया घोल में कम करने वाले एजेंट के रूप में थोड़ा ग्लूकोज या फॉर्मेलिन मिलाया जाता है, तो धात्विक सिल्वर कांच की सतह पर घनी चमकदार दर्पण परत के रूप में निकलता है। सिल्वर आयन बैक्टीरिया के विकास को रोकते हैं और, बहुत कम सांद्रता में भी, पीने के पानी को जीवाणुरहित करते हैं। चिकित्सा में, श्लेष्म झिल्ली के कीटाणुशोधन के लिए, विशेष योजक (प्रोटारगोल, कॉलरगोल, आदि) के साथ स्थिर चांदी के कोलाइडल समाधान का उपयोग किया जाता है। चांदी (तांबा, टिन, पारा जैसी अन्य भारी धातुओं के साथ) एक जीवाणुनाशक प्रभाव डालने में सक्षम है छोटी सांद्रता में प्रभाव (तथाकथित ऑलिगोडायनामिक प्रभाव)। 0.15 मिलीग्राम/लीटर से ऊपर सिल्वर आयनों की सांद्रता पर एक स्पष्ट जीवाणुनाशक प्रभाव (कुछ बैक्टीरिया को विश्वसनीय रूप से मारने की क्षमता) देखा जाता है। 0.05 - 0.1 मिलीग्राम/लीटर की मात्रा में, सिल्वर आयनों में केवल बैक्टीरियोस्टेटिक प्रभाव (बैक्टीरिया के विकास और प्रजनन को रोकने की क्षमता) होता है।हालाँकि चांदी की कीटाणुशोधन दर ओजोन या यूवी किरणों जितनी अधिक नहीं है, चांदी के आयन लंबे समय तक पानी में रह सकते हैं, जिससे दीर्घकालिक कीटाणुशोधन मिलता है।चांदी की क्रिया का तंत्र अभी तक पूरी तरह से समझा नहीं जा सका है। वैज्ञानिकों का मानना है कि कीटाणुनाशक प्रभाव तब देखा जाता है जब सकारात्मक रूप से चार्ज किए गए चांदी और तांबे के आयन सूक्ष्मजीव कोशिकाओं की नकारात्मक चार्ज सतह के साथ इलेक्ट्रोस्टैटिक बंधन बनाते हैं। ये इलेक्ट्रोस्टैटिक बंधन तनाव पैदा करते हैं जो कोशिकाओं की पारगम्यता को ख़राब कर सकते हैं और उनमें महत्वपूर्ण मात्रा में पोषक तत्वों के प्रवेश को कम कर सकते हैं। कोशिकाओं के अंदर घुसकर, चांदी और तांबे के आयन अमीनो एसिड के साथ परस्पर क्रिया करते हैं, जो प्रोटीन का हिस्सा होते हैं और प्रकाश संश्लेषण की प्रक्रिया में उपयोग किए जाते हैं। परिणामस्वरूप, सूक्ष्मजीवों के लिए सौर विकिरण को भोजन और ऊर्जा में परिवर्तित करने की प्रक्रिया बाधित हो जाती है, जिससे उनकी मृत्यु हो जाती है। कई अध्ययनों के परिणामस्वरूप, अधिकांश रोगजनक सूक्ष्मजीवों, साथ ही वायरस पर सिल्वर आयनों का प्रभावी जीवाणुनाशक प्रभाव पड़ा है। पुष्टि की गई. हालाँकि, सूक्ष्मजीवों की बीजाणु बनाने वाली किस्में व्यावहारिक रूप से चांदी के प्रति असंवेदनशील होती हैं। चांदी के आयनों के साथ पानी का संवर्धन कई तरीकों से किया जा सकता है: चांदी की सतह के साथ पानी का सीधा संपर्क, चांदी के लवण और इलेक्ट्रोलाइटिक समाधान के साथ पानी का उपचार तरीका।
कॉपर आयनों के लिए गुणात्मक प्रतिक्रिया
पोटेशियम हेक्सासायनोफेरेट (2) K 4 तांबे के नमक के घोल के साथ Cu 2 का एक लाल-भूरा अवक्षेप बनाता है, जो तनु एसिड में अघुलनशील होता है, लेकिन अमोनिया घोल में घुलनशील होता है।
Cu 2+ + 4+ ® Cu 2 ¯CuSO 4 घोल की 3 बूंदों में K 4 नमक घोल की 2 बूंदें मिलाएं। लाल अवक्षेप के निर्माण का निरीक्षण करें। अवक्षेप को अपकेंद्रित्र करें और इसमें अमोनिया घोल की 3-5 बूंदें डालें।
कॉपर आयन Cu2+ का पता लगाने के लिए प्रतिक्रियाएँ
समूह अभिकर्मक H2S की क्रिया. हाइड्रोजन सल्फाइड तांबे के लवण के अम्लीय घोल में कॉपर (II) सल्फाइड का एक काला अवक्षेप बनाता है: CuS: CuSO4 + H2S = CuS + H2SO4, Cu2+ + H2S = CuS + 2H+।
अमोनियम हाइड्रॉक्साइड NH4OH की क्रिया। अधिक मात्रा में लिया गया अमोनियम हाइड्रॉक्साइड NH4OH, तांबे के लवण के साथ गहरे नीले रंग के टेट्रामाइन कॉपर (II) का एक जटिल धनायन बनाता है:
CuSO4 + 4NH4OH = SO4 + 4H2O,
Cu2+ + 4NH4OH = + + 4H2O.
Ag+ सिल्वर आयन का पता लगाने वाली प्रतिक्रियाएँ
समूह अभिकर्मक HC1 की क्रिया. हाइड्रोक्लोरिक एसिड, Ag+ लवण के घोल के साथ, सिल्वर क्लोराइड AgCl का एक सफेद अवक्षेप बनाता है, जो व्यावहारिक रूप से पानी में अघुलनशील होता है:
एजी+ + सीएल- = एजीसीएल।
चांदी धनायन का पता लगाना. हाइड्रोक्लोरिक एसिड और उसके लवणों के घोल (यानी, सीएल-क्लोराइड आयन), Ag+ लवणों के घोल के साथ, सिल्वर क्लोराइड AgCl का व्यावहारिक रूप से पानी में अघुलनशील सफेद अवक्षेप बनाते हैं, जो NH4OH घोल की अधिकता में अच्छी तरह से घुल जाता है; इस मामले में, एक पानी में घुलनशील जटिल सिल्वर नमक, डायमाइन सिल्वर क्लोराइड बनता है। नाइट्रिक एसिड की बाद की कार्रवाई के साथ, जटिल आयन नष्ट हो जाता है और सिल्वर क्लोराइड फिर से अवक्षेपित हो जाता है (सिल्वर लवण के इन गुणों का उपयोग इसका पता लगाने के लिए किया जाता है):
AgNO3 + HCl = AgCl + HNO3,
AgCl + 2NH4OH = सीएल + 2H2O,
सीएल + 2HNO3 = AgCl + 2NH4NO3.
90. II B समूह के तत्व. सबसे महत्वपूर्ण यौगिकों के विशिष्ट गुण, जैविक भूमिका। तांबा- और जस्ता युक्त एंजाइमों की जटिल प्रकृति। Zn 2+ आयनों के लिए विश्लेषणात्मक प्रतिक्रियाएँ।
एंजाइम प्राकृतिक प्रोटीन उत्प्रेरक हैं। कुछ एंजाइमों में विशुद्ध रूप से प्रोटीन संरचना होती है और उन्हें अपनी गतिविधि प्रदर्शित करने के लिए किसी अन्य पदार्थ की आवश्यकता नहीं होती है। हालाँकि, एंजाइमों का एक बड़ा समूह है जिनकी गतिविधि केवल कुछ गैर-प्रोटीन यौगिकों की उपस्थिति में दिखाई देती है। इन यौगिकों को सहकारक कहा जाता है। सहकारक, उदाहरण के लिए, धातु आयन या जटिल संरचना के कार्बनिक यौगिक हो सकते हैं - इन्हें आमतौर पर कोएंजाइम कहा जाता है। यह स्थापित किया गया है कि एंजाइम के सामान्य कामकाज के लिए, कभी-कभी कोएंजाइम और धातु आयन दोनों की आवश्यकता होती है, जो सब्सट्रेट अणु के साथ मिलकर एक टर्नरी कॉम्प्लेक्स बनाते हैं। इस प्रकार, धातुएँ एक अपूरणीय भाग के रूप में जैविक मशीनों का हिस्सा हैं। फॉस्फोरिक एसिड अवशेषों के स्थानांतरण पर काम करने के लिए मैग्नीशियम आयनों की आवश्यकता होती है, और पोटेशियम आयनों की भी समान उद्देश्यों के लिए आवश्यकता होती है; प्रोटीन के हाइड्रोलिसिस के लिए जिंक आयन आदि की आवश्यकता होती है। नीचे हम इन मुद्दों की विस्तार से जांच करेंगे। एंजाइम, एक नियम के रूप में, एक ही प्रकार की प्रतिक्रियाओं को तेज करते हैं, और उनमें से केवल कुछ ही केवल एक विशिष्ट और एकल प्रतिक्रिया पर कार्य करते हैं। ऐसे एंजाइम, जिनमें पूर्ण विशिष्टता होती है, उनमें विशेष रूप से यूरिया शामिल होता है, जो यूरिया को विघटित करता है। अधिकांश एंजाइम सब्सट्रेट की अपनी पसंद में उतने सख्त नहीं होते हैं। उदाहरण के लिए, एक ही हाइड्रोलेस, कई अलग-अलग एस्टर के हाइड्रोलाइटिक अपघटन को उत्प्रेरित करने में सक्षम है। जैसे-जैसे जैविक अनुसंधान का रासायनिक पक्ष गहरा हुआ और रसायनज्ञ तेजी से जीवविज्ञानियों के सहायक और सहयोगी बन गए, नए खोजे गए एंजाइमों की संख्या में लगातार वृद्धि हुई; जल्द ही उनकी गिनती दर्जनों में नहीं, बल्कि सैकड़ों में होनी पड़ी। जैविक उत्प्रेरकों की सीमा के इस विस्तार के कारण एंजाइमों के वर्गीकरण और नामकरण में कुछ कठिनाइयाँ पैदा हुईं। पहले, एंजाइमों का नाम उस सब्सट्रेट के अनुसार रखा जाता था जिस पर वे कार्य करते थे, जिसमें अंत में "एज़ा" जोड़ा जाता था। इसलिए, यदि कोई एंजाइम चीनी माल्टोज़ पर कार्य करता है, तो इसे "माल्टेज़" कहा जाता था, यदि लैक्टोज़ पर - "लैक्टेज़", आदि। वर्तमान में, एक नामकरण अपनाया गया है जिसमें नाम एंजाइम के रासायनिक कार्य को भी दर्शाता है। "एज़ा" कण सरल एंजाइमों के लिए आरक्षित है। यदि प्रतिक्रिया में एंजाइमों का एक कॉम्प्लेक्स शामिल होता है, तो "सिस्टम" शब्द का उपयोग किया जाता है।
एंजाइमों को छह वर्गों में बांटा गया है:
ऑक्सीडोरडक्टेस। ये एंजाइम हैं जो रेडॉक्स प्रतिक्रियाओं को उत्प्रेरित करते हैं। ऑक्सीडोरडक्टेस के उदाहरणों में पाइरूवेट डिहाइड्रोजनेज शामिल है, जो पाइरुविक एसिड से हाइड्रोजन को हटाता है, कैटालेज़, जो हाइड्रोजन पेरोक्साइड को विघटित करता है, आदि।